��Ŀ����
����Ŀ��(1)�������( K2FeO4)������һ�������ˮ�����������壩�����Ҹ�����ص�����Ҳ�ڽ����С���ͼ1�Ǹ�����ص�ģ��ʵ��װ�ã�
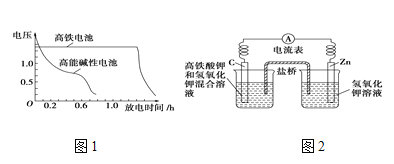
�ٸõ�طŵ�ʱ�����ĵ缫��ӦʽΪ____________________________________��
��������ʢ�б���KCl��Һ������������������________(����������������)�ƶ������������ӽ���Ĥ�������ţ����������______(����������������)�ƶ���
��ͼ2Ϊ������غͳ��õĸ��ܼ��Ե�صķŵ����ߣ��ɴ˿ɵó�������ص��ŵ���_____________________________________________________________��
(2)����������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ����ͼ��ʾ����������ĵ缫��Ӧʽ��____________________��A��____________��
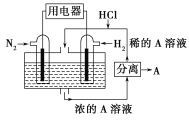
(3)����ԭ��ع���ԭ���ⶨ����β����CO��Ũ�ȣ���װ����ͼ��ʾ���õ����O2�������ڹ������NASICON(������)�������ƶ�������ʱO2�����ƶ�����________(������a��b��������b��a��)�����������ĵ缫��ӦʽΪ___________________��

���𰸡�FeO42-+3e-+4H2O=Fe(OH)3+5OH- �� �� �ŵ�ʱ�䳤�ҵ�ѹ�ȶ� N2+6e-+8H+=2NH4+ NH4Cl ��b��a CO-2e-+O2-=CO2
��������
��1���ٸ��ݵ��װ�ÿ�֪CΪ������ZnΪ������������ؾ��н�ǿ�������ԣ������ϸ�����ط�����ԭ��Ӧ����Fe(OH)3��
�����ſ�����ƽ���ɵ����ã����������ƶ����������������ƶ���
����ͼ��֪������ص��ŵ㣺ʹ��ʱ�䳤������ʱ��ѹ�ȶ���
��2����ͼ��֪���������ʧȥ���ӣ��ڸ�������������Ӧ�������õ�����������������ԭ��Ӧ��������HCl��Ӧ����NH4Cl��
��3���������Һ���������������ƶ������������ƶ��������ɸ���������������װ������ȼ�ϵ�ؼ�ԭ��ص�װ�ã�COΪȼ�ϣ��ڸ���ͨ�룬ʧ���ӷ���������Ӧ�������е�����������ͨ�룬�õ����ӷ�����ԭ��Ӧ��
��1���ٸ��ݵ��װ�ÿ�֪CΪ������ZnΪ������������ؾ��н�ǿ�������ԣ������ϸ�����ط�����ԭ��Ӧ����Fe(OH)3���缫��ӦΪ��FeO42-+3e-+4H2O=Fe(OH)3+5OH-��
�����������������ƶ����������������ƶ���������������Ҳ��ƶ���K+������ƶ������������ӽ���Ĥ�������ţ���K+������ƶ���
����ͼ��֪������ص��ŵ㣺ʹ��ʱ�䳤������ʱ��ѹ�ȶ���
��2����ͼ��֪����װ�õ��ܷ�Ӧ�Ǻϳɰ��ķ�Ӧ������ʧȥ���ӣ��ڸ�������������Ӧ�������õ����ӣ�������������ԭ��Ӧ����ô�����ĵ缫��ӦΪ��N2+6e-+8H+=2NH4+��������HCl��Ӧ����NH4Cl����˵������NH4Cl��
��3���������Һ���������������ƶ������������ƶ��������ɸ����������������O2�ɵ缫b��缫a�ƶ������ɵ缫aͨ������������缫b����װ����COΪȼ�ϣ��ڸ���(��a��)ͨ�룬ʧ���ӷ���������Ӧ���缫��ӦΪ��![]() ��
��

����Ŀ��![]() ��
��![]() ��������ӦΪ
��������ӦΪ![]()
![]() ������
������![]() �����ܱ������г���
�����ܱ������г���![]() ��
��![]() ���д�������Ӧ����ͬ�¶���ƽ����ϵ��
���д�������Ӧ����ͬ�¶���ƽ����ϵ��![]() ��CO���������
��CO���������![]() ���¶ȱ仯���±���ʾ��
���¶ȱ仯���±���ʾ��
������� �¶� |
|
|
| a | a |
| c | b |
��ã�![]() ������˵����ȷ����
������˵����ȷ����![]()
![]()
A.![]() ����
����![]()
B.![]() ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ
ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ![]()
C.![]() ʱ��
ʱ��![]() �����ܱ������г���
�����ܱ������г���![]() ��
��![]() ���д�������Ӧ���ﵽƽ��ʱ��
���д�������Ӧ���ﵽƽ��ʱ��![]() Ϊ
Ϊ![]()
D.![]() ʱ��
ʱ��![]() �����ܱ������г�������ʵ���
�����ܱ������г�������ʵ���![]() ��
��![]() ��CO��
��CO��![]() ���д�������Ӧ����ʱ��Ӧ���������ƶ�
���д�������Ӧ����ʱ��Ӧ���������ƶ�