题目内容
下列金属中在常温下不溶于浓硝酸的是( )
| A、铁 | B、镁 | C、锌 | D、铜 |
考点:硝酸的化学性质
专题:
分析:浓硝酸具有强氧化性,Fe、Al在常温下和硝酸发生钝化现象而不溶于浓硝酸,据此分析解答.
解答:
解:A.常温下,浓硝酸和Fe发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以铁不溶于浓硝酸,故A选;
B.常温下,镁和浓硝酸发生氧化还原反应生成硝酸镁、氮的化合物和水,所以能溶于浓硝酸,故B不选;
C.常温下,Zn和浓硝酸发生氧化还原反应生成硝酸锌、氮的化合物和水,所以能溶于浓硝酸,故C不选;
D.常温下,Cu和浓硝酸发生氧化还原反应生成硝酸铜、二氧化氮和水,所以能溶于浓硝酸,故D不选;
故选A.
B.常温下,镁和浓硝酸发生氧化还原反应生成硝酸镁、氮的化合物和水,所以能溶于浓硝酸,故B不选;
C.常温下,Zn和浓硝酸发生氧化还原反应生成硝酸锌、氮的化合物和水,所以能溶于浓硝酸,故C不选;
D.常温下,Cu和浓硝酸发生氧化还原反应生成硝酸铜、二氧化氮和水,所以能溶于浓硝酸,故D不选;
故选A.
点评:本题考查浓硝酸的性质,知道浓硝酸具有强氧化性、不稳定性、酸性,知道钝化原理,题目难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
下列事实不能用勒沙特列原理解释的是( )
| A、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| B、钢铁在潮湿的空气中容易生锈 |
| C、工业合成氨时常用通过量氮气的方法提高氢气的转化率 |
| D、工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
下列离子方程式正确的是( )
| A、明矾溶液与氢氧化钡溶液反应使SO42-恰好沉淀完全:SO42-+Ba2+═BaSO4↓ |
| B、将Na2CO3溶于水,溶液呈碱性:CO32-+H2O═HCO3-+OH- |
| C、次氯酸钙溶液中通入过量二氧化碳:ClO-+CO2+H2O═HCO3-+HClO |
| D、在酸性高锰酸钾溶液中滴加双氧水后产生气体:H2O2+2MnO4-+6H2O═2Mn2++3O2↑+4H2O |
下列有关仪器的使用正确的是( )
| A、用量筒量取22.50mL的浓硫酸 |
| B、滴定管的零刻度在上面,量筒的零刻度在下面,容量瓶没有零刻度 |
| C、酸式滴定管只能装酸性溶液,碱式滴定管只能装碱性溶液 |
| D、能用酒精灯加热的有:锥形瓶、烧杯、烧瓶、蒸发皿、坩埚 |
下列溶液一定呈碱性的是( )
| A、c(OH-)=1×10-6mol/L |
| B、c(OH-)>c(H+)的溶液 |
| C、能使甲基橙变黄的溶液 |
| D、含OH- 的溶液 |
下列有关化学用语的说法中正确的是( )
| A、次氯酸的结构式为:H-Cl-O |
B、-OH与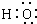 都表示羟基 都表示羟基 |
C、S2-的结构示意图:S2-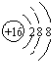 |
D、苯分子的球棍模型示意图: |
下列物质中,一氯代物种数最多的是( )
| A、邻二乙苯 |
| B、2-甲基-3-乙基戊烷 |
| C、乙苯 |
| D、1-甲基-3-乙基环己烷 |