题目内容
【题目】金属的回收是工业生产中的重要课题,利用某工业冶炼废渣![]() 主要成分为
主要成分为![]() 和铁、锡、铅、铜的氧化物
和铁、锡、铅、铜的氧化物![]() 回收锡、铜、铅的工艺流程如图所示:
回收锡、铜、铅的工艺流程如图所示:

回答下列问题:
![]() 电炉冶炼时,焦炭的作用是______
电炉冶炼时,焦炭的作用是______![]() 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂”![]() ,将焦炭粉碎的目的是______。熔剂的主要成分是氟石
,将焦炭粉碎的目的是______。熔剂的主要成分是氟石![]() ,高温下能与
,高温下能与![]() 反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为______。
反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为______。
![]() 脱铁后的溶液中含有少量的
脱铁后的溶液中含有少量的![]() ,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为______。
,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为______。
![]() 已知
已知![]() 可表示为:
可表示为:![]() ,则
,则![]() 也可用氧化物表示为:______。
也可用氧化物表示为:______。
![]() 脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是______。
脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是______。
![]() 若该冶炼废渣中锡的质量分数为
若该冶炼废渣中锡的质量分数为![]() ,30t废渣制得精锡
,30t废渣制得精锡 ![]() ,则锡的回收率为______。
,则锡的回收率为______。
【答案】还原剂 增大反应物之间的接触面,加快反应速率 ![]()
![]()
![]() 取最后一次洗液少量于试管中,加盐酸酸化,再加
取最后一次洗液少量于试管中,加盐酸酸化,再加![]() 溶液,若无现象,说明滤渣已洗净
溶液,若无现象,说明滤渣已洗净 ![]()
【解析】
冶炼废渣![]() 主要成分为二氧化硅和锡、铜、铅、铁的氧化物
主要成分为二氧化硅和锡、铜、铅、铁的氧化物![]() 加入焦炭、溶剂可得到锡、铜、铅、铁等,水碎渣主要成分为二氧化硅,可用于制备水泥,在合金中加入稀硫酸、硫酸铜进行脱铁,然后进行氧化、焙烧,加入稀硫酸生成硫酸铜分离后得到滤渣含有锡、铅渣,加入碳酸氢铵溶液脱硫,最后得到锡、铅;
加入焦炭、溶剂可得到锡、铜、铅、铁等,水碎渣主要成分为二氧化硅,可用于制备水泥,在合金中加入稀硫酸、硫酸铜进行脱铁,然后进行氧化、焙烧,加入稀硫酸生成硫酸铜分离后得到滤渣含有锡、铅渣,加入碳酸氢铵溶液脱硫,最后得到锡、铅;
(1)焦炭具有还原性,将焦炭粉碎,可增大固体表面积,加快反应速率,使反应更充分,熔剂的主要成分是氟石![]() ,高温下能与
,高温下能与![]() 反应生成两种钙盐,其中之一为
反应生成两种钙盐,其中之一为![]() ,另一种为硅酸钙;
,另一种为硅酸钙;
(2)Fe比Sn活泼,可发生置换反应;
(3)已知![]() 可表示为:
可表示为:![]() ,低价在前,高价在后,据此特征结合原子守恒书写;
,低价在前,高价在后,据此特征结合原子守恒书写;
(4)可用检验硫酸根离子的方法检验固体是否洗涤干净;
(5)若该冶炼废渣中锡的质量分数为![]() ,30t废渣制得精锡1t,理论值应为
,30t废渣制得精锡1t,理论值应为![]() ,依次计算回收率。
,依次计算回收率。
(1)焦炭具有还原性,在冶炼时起到还原剂的作用,将焦炭粉碎,可增大固体表面积,加快反应速率,使反应更充分,熔剂的主要成分是氟石![]() ,高温下能与
,高温下能与![]() 反应生成两种钙盐,其中之一为
反应生成两种钙盐,其中之一为![]() ,另一种为硅酸钙,反应的化学方程式为3CaF2+3SiO2
,另一种为硅酸钙,反应的化学方程式为3CaF2+3SiO2![]() CaSiF6+2CaSiO3;
CaSiF6+2CaSiO3;
(2)Fe比Sn活泼,可发生置换反应,反应的离子方程式为![]() ;
;
(3)已知![]() 可表示为:
可表示为:![]() ,则
,则![]() 也可用氧化物表示为:
也可用氧化物表示为:![]() ;
;
(4)检验滤渣是否洗涤干净的方法是取少量末次洗涤液于试管中,滴加氯化钡溶液,若不出现浑浊,说明滤渣已洗涤干净;
(5)若该冶炼废渣中锡的质量分数为![]() ,30t废渣制得精锡1t,则锡的回收率为
,30t废渣制得精锡1t,则锡的回收率为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.BC.CD.D
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜![]() 含杂质铁
含杂质铁![]() 制备氯化铜晶体
制备氯化铜晶体![]()
![]() 的流程如下:
的流程如下:

已知常温下,![]() 、
、![]() 的氢氧化物开始沉淀和沉淀完全时的pH见下表:
的氢氧化物开始沉淀和沉淀完全时的pH见下表:
金属离子 |
|
|
氢氧化物开始沉淀时的pH |
|
|
氢氧化物完全沉淀时的pH |
|
|
请回答下列问题:
![]() 溶液I中加入试剂X可以调节溶液pH,从而除去
溶液I中加入试剂X可以调节溶液pH,从而除去![]() 且不引入杂质。
且不引入杂质。
![]() 试剂X可选用下列物质中的______
试剂X可选用下列物质中的______![]() 填代号
填代号![]() 。
。
![]()
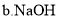
![]()
![]()
![]() 调节溶液pH时,理论上可选择pH最大范围是______。
调节溶液pH时,理论上可选择pH最大范围是______。
![]() 由溶液Ⅱ制备
由溶液Ⅱ制备![]() 的操作依次为:边滴加浓盐酸边加热浓缩、______
的操作依次为:边滴加浓盐酸边加热浓缩、______![]() 填操作名称
填操作名称![]() 、过滤、洗涤干燥。
、过滤、洗涤干燥。
![]() 室温下,将NaOH溶液逐滴加入到浓度均为
室温下,将NaOH溶液逐滴加入到浓度均为![]() 的
的![]() 和
和![]() 混合溶液中,先生成的沉淀是______
混合溶液中,先生成的沉淀是______![]() 室温时
室温时![]() ,
,![]() 。
。
![]() 某学习小组用碘量法测定
某学习小组用碘量法测定![]() 样品的纯度
样品的纯度![]() 杂质不与发生反应
杂质不与发生反应![]() 实验如下:
实验如下:
![]() 准确称取
准确称取![]() 样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液。
样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液。![]() 已知:
已知:![]()
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴指示剂,用c
待测溶液于锥形瓶中,加几滴指示剂,用c![]() 标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V
标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V![]() 。(已知:
。(已知:![]() )
)
![]() 实验中使用的指示剂名称为______,达到滴定终点时的溶液颜色变化为______。
实验中使用的指示剂名称为______,达到滴定终点时的溶液颜色变化为______。
![]() 该样品中
该样品中![]() 的质量分数为______
的质量分数为______![]() 用含m、c、V的代数式表示,不用化简
用含m、c、V的代数式表示,不用化简![]() 。
。



