题目内容
【题目】氯化亚铜(CuCl)是一种重要化工原料,难溶于水,在潮湿空气中易水解氧化。回答下列问题:
(1)CuCl的保存方法是_______。
(2)CuCl在含一定浓度Cl-溶液中会部分溶解,存在如下平衡:2CuCl(s)![]() Cu++CuCl2- ΔH<0。溶液中c(Cu+)和c(CuCl2-)的关系如图。
Cu++CuCl2- ΔH<0。溶液中c(Cu+)和c(CuCl2-)的关系如图。
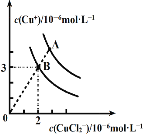
①上述反应在B点的平衡常数K=_____。
②使图中的A点变为B点的措施可以是_____。
(3)利用CuCl难溶于水的性质,可以除去水溶液中的Cl-。
①除Cl-的方法是向含Cl-的溶液同时加入Cu和CuSO4。反应的离子方程式为________。
②已知:Cu+Cu2+![]() 2Cu+ K1=7.6×10-7;Ksp(CuCl)=2.0×10-6。通过计算说明上述除Cl-的反应能完全进行的原因。_____
2Cu+ K1=7.6×10-7;Ksp(CuCl)=2.0×10-6。通过计算说明上述除Cl-的反应能完全进行的原因。_____
③若用Zn替换Cu可加快除Cl-速率,但需控制溶液的pH。若pH过低,除Cl-效果下降的原因是_____。
【答案】在干燥环境下,密封保存 6×10-12升高温度Cu + Cu2+ + 2Cl-= 2CuCl![]() ,K值很大,反应可以完全进行若pH过低,Zn会与H+反应
,K值很大,反应可以完全进行若pH过低,Zn会与H+反应
【解析】
(1)由于CuCl在潮湿空气中易水解氧化,因此保存CuCl时应在干燥环境下,密封保存;
(2)①根据方程式和图像可知反应在B点的平衡常数K=c(Cu2+)×c(CuCl2-)=3×10-6×2×10-6=6×10-12;
②该反应的正反应是放热反应,且A点变为B点,c(Cu2+)和c(CuCl2-)均降低,说明平衡向正反应方向进行,因此采取的措施是升高温度;
(3)①CuCl中Cu显+1价,Cu显0价,CuCl2中Cu显+2价,因此根据电子得失守恒可知离子反应方程式为Cu+Cu2++2Cl-=2CuCl↓;
②根据①的反应方程式可知推出平衡常数![]() ,K值很大,所以反应可以完全进行;
,K值很大,所以反应可以完全进行;
③Zn是活泼金属,pH过低,氢离子浓度过大,Zn与H+发生反应,造成除Cl-效果下降。