题目内容
19.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,5.6 L四氯化碳(CCl4)含有的分子数为0.25NA | |
| D. | NA个一氧化碳分子和0.5 mol 甲烷的质量比为7:4 |
分析 A、二氧化碳和氧气中均含2个氧原子;
B、求出氮气的物质的量,然后根据1mol氮气中含14mol电子来分析;
C、标况下四氯化碳为液态;
D、NA个CO的物质的量为1mol,求出其质量.
解答 解:A、二氧化碳和氧气中均含2个氧原子,故NA个CO2和O2组成的混合物中含2NA个氧原子,与两者的比例无关,故A正确;
B、14g氮气的物质的量n=$\frac{14g}{28g/mol}$=0.5mol,而1mol氮气中含14mol电子,故0.5mol氮气中含7mol电子即7NA个,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、NA个CO的物质的量为1mol,其质量m=nM=1mol×28g/mol=28g;0.5mol甲烷的质量m=nM=0.5mol×16g/mol=8g,故两者的质量之比为28g:8g=7:2,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.用下列方法均可制得氯气:
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
10.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol 0~4min时,容器内气体压强为101KPa,反应过程中,SO2、O2、SO3的物质的量n (mol)的变化如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:
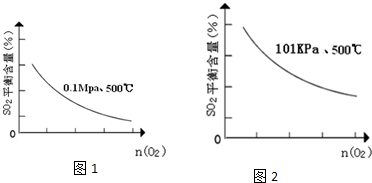
在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:

在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
7.以下实验原理或操作中,正确的是( )
| A. | 用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高 | |
| B. | 仰视量筒刻度量取一定量浓硫酸所配制的0.10 mol•L-1 H2SO4溶液的浓度结果偏低 | |
| C. | 焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色 | |
| D. | 要将溶解在CCl4中的碘分离出来,以用蒸馏法,因为碘易升华,先分离出来 |
4.矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的.此处所指的风化作用是指矿物与水和CO2同时作用的过程.例如钾长石风化生成高岭土,高岭土其成分为[AlnSi2O5(OH)4],则n为( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
11.下列有关实验原理、操作或现象不正确的是( )
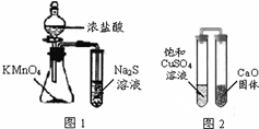

| A. | 下列有关实验原理、操作或现象不正确的是图1锥形瓶中滴入浓盐酸后充满黄绿色气体,试管中出现浅黄色浑浊 | |
| B. | 图2放置一段时间后,饱和CuSO4溶液中出现白色晶体 | |
| C. | 用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色说明该溶液中不含钾元素 | |
| D. | 蒸馏时,将温度计水银球靠近蒸馏烧瓶支管口处 |
8.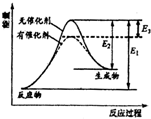 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )| A. | 该反应为放热反应 | B. | 该反应的焓变△H=E3 | ||
| C. | 催化剂不能降低反应的活化能 | D. | 该反应逆反应的焓变△H=E2-E1 |
9.关于0.5molO2的下列说法正确的是( )
| A. | 体积为11.2L | B. | 摩尔质量是16g/mol | ||
| C. | 质量为32g | D. | 约含有6.02×1023个氧原子 |