题目内容
6. 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.下列有关该反应的说法正确的是( )
| A. | TiCl4是还原剂 | B. | Mg被氧化 | ||
| C. | TiCl4发生氧化反应 | D. | Mg得到电子 |
分析 TiCl4+2Mg=Ti+2MgCl2反应中Ti元素化合价降低,Mg的化合价升高,结合氧化还原反应的概念分析解答.
解答 解:TiCl4+2Mg=Ti+2MgCl2反应中Ti元素化合价降低,Mg的化合价升高,
A.反应中Ti元素化合价降低,则TiCl4为氧化剂,故A错误;
B.反应中Mg失电子,则Mg被氧化,故B正确;
C.反应中Ti元素化合价降低,则TiCl4发生还原反应,故C错误;
D.反应中Mg的化合价升高失电子,故D错误;
故选B.
点评 本题考查氧化还原反应,明确元素化合价变化是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列卤族元素的有关实验,说法正确的是( )
| A. | 往稀米粥中加入少量加碘食盐,能检验食盐中是否含碘 | |
| B. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加人适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 | |
| C. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和苯 | |
| D. | 浓盐酸长期暴露在空气中因为见光分解而浓度降低 |
8.Na2FeO4是一种新型水处理剂,可以通过下列反应制取:
湿法制备的主要反应方程为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4+2Na2SO4
下列有关该反应的说法错误的是( )
湿法制备的主要反应方程为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4+2Na2SO4
下列有关该反应的说法错误的是( )
| A. | 两反应中Na2FeO4均为氧化产物 | |
| B. | Na2FeO4有强氧化性,可消毒杀菌,其还原产物能吸附水中杂质 | |
| C. | 干法中每生成1mol Na2FeO4转移3mol电子 | |
| D. | 碱性条件下,NaClO氧化性大于Na2FeO4 |
14.下列各组中的两种有机物,无论以何种比例混合,只要混合物总质量不变,完全燃烧后生成水的质量也不变,符合这一条件的组合是( )
| A. | CH4O和C2H4O2 | B. | C8H10和C4H10 | C. | C2H4和C2H4O | D. | C8H8和C4H8O3 |
15.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 电解AlCl3饱和溶液,可制得金属铝 |
16.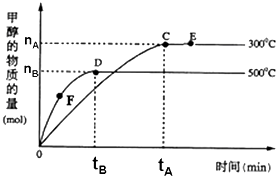 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )| A. | 正反应的△H<0 | |
| B. | 容器中气体的总物质的量E点大于D点 | |
| C. | F点的正反应速率大于逆反应速率 | |
| D. | v(甲醇)=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示500℃时反应在D点的速率 |
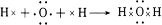 .
. ,属于离子化合物(填“离子化合物”,“共价化合物”)
,属于离子化合物(填“离子化合物”,“共价化合物”)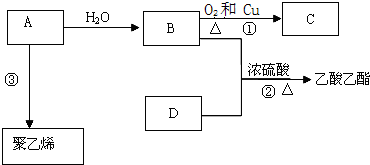
 .
.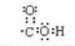 ;
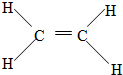
;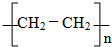 反应类型:加聚反应.
反应类型:加聚反应.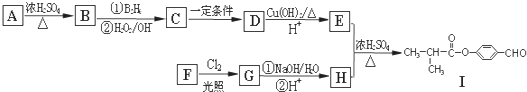
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为 .
.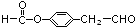 .
.