题目内容
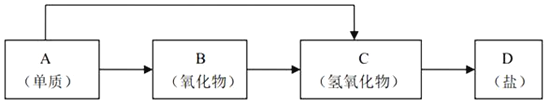
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。根据图示转化关系回答:
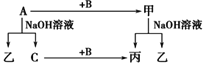
(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
【答案】Al O2 Al2O3 NaAlO2 2Al+2NaOH+2H2O===2 NaAlO2+3H2 ↑ Al2O3+2OH ===2AlO2-+H2O 0.1 mol 0.3 mol
【解析】
常见金属单质中能与NaOH溶液反应的只有Al,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,则A是Al、乙是NaAlO2、C是H2;铝的氧化物为两性氧化物,能与氢氧化钠溶液反应生成偏铝酸钠和水,由图示可知铝与B反应生成的化合物甲能与氢氧化钠溶液反应生成偏铝酸钠和丙,且氢气能与B反应生成丙,则甲是Al2O3、丙是H2O、B是O2。
(1)由上述分析可知,A为Al,B为O2,甲是Al2O3,乙是NaAlO2,故答案为:Al;O2;Al2O3;NaAlO2;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)标准状况下3.36 L氢气的物质的量为![]() ═0.15mol,根据铝与NaOH溶液反应的方程式可知消耗的Al的物质的量为0.15mol×
═0.15mol,根据铝与NaOH溶液反应的方程式可知消耗的Al的物质的量为0.15mol×![]() ==0.1mol,转移电子数目为0.1mol×3=0.3mol,故答案为:0.1mol,0.3 mol。
==0.1mol,转移电子数目为0.1mol×3=0.3mol,故答案为:0.1mol,0.3 mol。

 优学名师名题系列答案
优学名师名题系列答案