题目内容
20.下列关于某物质是否为电解质的判断正确的是( )| A. | 固体氯化钠不导电,所以氯化钠不是电解质 | |
| B. | 氯化氢水溶液能导电,所以氯化氢是电解质 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | 硫酸溶液能导电,所以稀硫酸是电解质 |
分析 水溶液中或熔融状态下导电的化合物为电解质,水溶液中和熔融状态下都不导电的化合物为非电解质,导电的条件是化合物自身能在一定条件下电离出离子导电,导电实质是含有自由移动电子或离子,据此分析判断.
解答 解:A.固体氯化钠不存在自由移动的离子不导电,溶于水会导电,所以氯化钠是电解质,故A错误;
B.氯化氢在化合物水溶液中导电,属于电解质,故B正确;
C.SO2溶于水能导电,是因为二氧化硫和水反应生成电解质亚硫酸,本身不能电离,所以SO2是非电解质,故C错误;
D.稀硫酸是硫酸的水溶液为混合物,不是电解质,故D错误;
故选B.
点评 本题考查了电解质、非电解质的导电性分析和判断,主要是概念实质理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
10.甲烷分子是以C为中心的正四面体结构,而不是正方形的平面结构的理由是( )
| A. | CH3C1不存在同分异构体 | |
| B. | CHC13不存在同分异构体 | |
| C. | CH2C12不存在同分异构体 | |
| D. | CH4中的四个价键的键角和键长都相等 |
8.下列物质互为同分异构体的是( )
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 甲烷和乙烷 | ||
| C. | 石墨和C60 | D. | 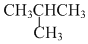 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
15.下列说法正确的是( )
| A. | NaCl与浓H2SO4加热可制HCl,推测NaI与浓H2SO4加热可制HI | |
| B. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 | |
| C. | FeCl3能腐蚀Cu刻制印刷电路板,是因为铁比铜金属性强 | |
| D. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
12.下列各组物质中,互为同分异构体的是( )
| A. | 淀粉和纤维素 | B. | 甲烷和乙烷 | C. | 蔗糖和麦芽糖 | D. | 12C和14C |
9.A、B两元素为某周期ⅡA族和ⅢA族元素,若A元素的原子序数为m,则B元素的原子序数可能为( )
①m+1
②m+8
③m+11
④m+18
⑤m+25
⑥m+32.
①m+1
②m+8
③m+11
④m+18
⑤m+25
⑥m+32.
| A. | ①③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②④⑥ |
