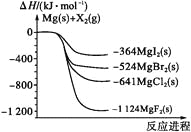
题目内容
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验所用仪器如图:
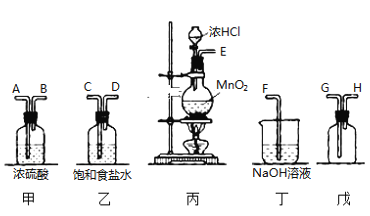
(1)连接上述仪器的正确顺序是 ________________________ 。
(2)气体发生装置中进行反应的离子方程式是_________________________;当0.5molMnO2反应时,生成的Cl2在标准状况下的体积约为 ________L。
(3)在装置中:乙中饱和食盐水的作用是___________________________,甲中浓硫酸的作用是_________________________。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸,如果有Cl2产生,可观察到的现象是____________________________,写出反应的化学方程式______________________________________。
(5)若用盛有过量烧碱溶液的小烧杯吸收标准状况下VL氯气,充分反应后,溶液中含等物质的量的次氯酸钠和氯酸钠,则反应消耗的NaOH的物质的量为____________mol。
【答案】丙乙甲戊丁 4H+ + 2Cl- + MnO2![]() Mn2+ + Cl2↑+2H2O 11.2 除去Cl2中的HCl 干燥氯气(或除去氯气中的水蒸气) 试纸变蓝 Cl2 + 2KI = 2KCl + I2
Mn2+ + Cl2↑+2H2O 11.2 除去Cl2中的HCl 干燥氯气(或除去氯气中的水蒸气) 试纸变蓝 Cl2 + 2KI = 2KCl + I2 ![]()
【解析】
本题为氯气的制备和性质检验,装置丙为发生装置,依据浓盐酸的挥发性可知制取的氯气中含有氯化氢和水蒸气,依次通过洗气瓶乙和甲除去氯化氢和水蒸气,装置戊可收集干燥的氯气,又氯气有毒需要进行尾气处理,装置丁为吸收过量氯气装置,结合氯气的性质进行分析。
(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;收集装置中,因为氯气的浓度大于空气的,所以长导管进气短导管出气,最后氯气用氢氧化钠吸收,故连接上述仪器的正确顺序是;丙乙甲戊丁;
(2)气体发生装置中浓盐酸与二氧化锰在加热条件下制备氯气,其离子方程式为:4H+ + 2Cl- + MnO2![]() Mn2+ + Cl2↑+2H2O,根据方程式可知,当0.5molMnO2反应时,生成的Cl2的物质的量为0.5mol,则在标准状况下,其体积为0.5mol×22.4L/mol=11.2L,故答案为:4H+ + 2Cl- + MnO2
Mn2+ + Cl2↑+2H2O,根据方程式可知,当0.5molMnO2反应时,生成的Cl2的物质的量为0.5mol,则在标准状况下,其体积为0.5mol×22.4L/mol=11.2L,故答案为:4H+ + 2Cl- + MnO2![]() Mn2+ + Cl2↑+2H2O;11.2L;
Mn2+ + Cl2↑+2H2O;11.2L;
(3)生成的氯气中含有水蒸气和挥发出的氯化氢,因此乙中饱和食盐水的作用是除去Cl2中的HCl;甲中浓硫酸的作用是干燥氯气(或除去氯气中的水蒸气),故答案为:除去Cl2中的HCl;干燥氯气(或除去氯气中的水蒸气);
(4)氯气具有强氧化性,能把碘化钾氧化单质碘,碘遇淀粉显蓝色。则如果有氯气产生,可观察到的现象是试纸变蓝,反应的化学方程式为:Cl2 + 2KI = 2KCl + I2,故答案为:试纸变蓝;Cl2 + 2KI = 2KCl + I2;
(5)根据题意易知,氢氧化钠吸收氯气生成等物质的量的次氯酸钠和氯酸钠,依据氧化还原反应规律可知,还有氯化钠和水生成,其反应的化学方程式为:4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O,则4Cl2![]() 8NaOH,则吸收标准状况下VL氯气,消耗的NaOH的物质的量为
8NaOH,则吸收标准状况下VL氯气,消耗的NaOH的物质的量为![]() ×2=
×2=![]() mol,故答案为:
mol,故答案为:![]() 。
。