题目内容
下列说法正确的是( )
| A、某有机物燃烧后,只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n |
| B、乙烯能和溴、高锰酸钾发生加成反应使之褪色 |
| C、蒸气气态烃CxHy与适量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4,若体积减少,则y<4,否则y>4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含碳的质量分数越高 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断,烃及其衍生物的燃烧规律
分析:A.不一定为烃,可能为烃的衍生物;
B.乙烯可与酸性高锰酸钾发生氧化还原反应;
C.根据通式分析CxHy+(x+
)O2
xCO2+
H2O;
D.由C+O2
CO2,4H+O2→2H2O可知,消耗32g氧气需要碳12g,需要H元素4g,故等质量时,有机物含氢量越大,燃烧时消耗氧气越多.
B.乙烯可与酸性高锰酸钾发生氧化还原反应;
C.根据通式分析CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
D.由C+O2
| ||
解答:
解:A.某有机物燃烧后,只生成CO2和H2O,且二者物质的量相等,说明N(C):N(H)=1:2,可能为烃,分子式符合CnH2n,也可能为烃的衍生物,故A错误;
B.乙烯可与酸性高锰酸钾发生氧化还原反应,故B错误;
C.根据通式分析CxHy+(x+
)O2
xCO2+
H2O,可知如果反应前后气体体积不变则y=4;若气体体积减少,则y<4;若气体体积增大,则y>4,故C正确;
D.由C+O2
CO2,4H+O2→2H2O可知,消耗32g氧气需要碳12g,需要H元素4g,故等质量时,有机物含氢量越大,燃烧时消耗氧气越多,故D错误;
故选C.
B.乙烯可与酸性高锰酸钾发生氧化还原反应,故B错误;
C.根据通式分析CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
D.由C+O2
| ||
故选C.
点评:本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团及官能团与性质的关系为解答的关键,侧重常见有机物性质的考查,题目难度不大.

练习册系列答案
相关题目
医学界通过用放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下课断裂DNA杀死细胞,抑制艾滋病,关于14C的下列说法中正确的是( )
| A、14C原子与C60中普通碳原子的化学性质不同 |
| B、14C原子与14N原子所含中子数相同 |
| C、是C60的同素异形体 |
| D、与12C、13C是碳元素的三种同位素 |
有关H、D、T、HD、H2、D+、H-这七种微粒的说法正确的是( )
| A、互为同位素 |
| B、是七种氢元素 |
| C、电子数相同 |
| D、HD和H2均是单质 |
如图a为在恒温恒容密闭容器中分别充入X、Y、Z三种气体,一定条件下发生反应各物质浓度随时间的变化.若从t2开始,每个时刻只改变一个且不同的条件,物质Z的正、逆反应速率随时间变化如图b.下列分析不正确的是( )

A、0-t1时,v(Y)=
| ||
| B、t2时刻改变的条件可能是压强或催化剂 | ||
| C、该反应的正反应为放热反应 | ||
| D、该反应中Z一定为产物 |
10mL某气态烃,在50mL氧气里充分燃烧,得到液态水和体积为35mL的混合气体,则该烃可能是( )
| A、甲烷 | B、乙烷 | C、丙烷 | D、乙烯 |
下列叙述错误的是( )
| A、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| B、用高锰酸钾酸性溶液可区分己烷和3-己烯 |
| C、用水可区分苯和溴苯 |
| D、用金属钠可区分乙醇和乙醚 |
CH3CH2CHO的说法正确的是( )
| A、所有原子共面 |
| B、C原子采用sp3和sp2杂化 |
| C、三个C原子共线 |
| D、不可能发生加成和取代反 |
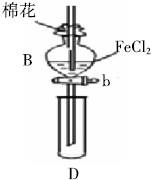 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下: 则
则 发生羟醛缩合反应的产物不可能是( )
发生羟醛缩合反应的产物不可能是( )


