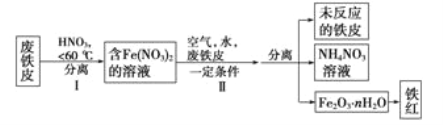
题目内容
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾).可用下列装置制备.
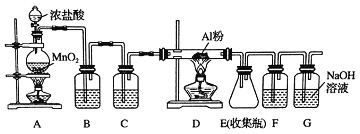
(1)装置B中盛放_____溶液,其作用是_____.F中的是_____溶液,其作用是_____.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为_____.
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是_____(填序号).
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
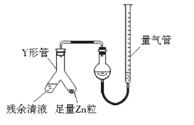
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如右图所示(夹持器具已略去).
①使Y形管中的残余清液与锌粒反应的正确操作是将_____转移到_____中.
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是_____(排除仪器和实验操作的影响因素)。
【答案】 饱和食盐水 除去氯化氢气体 浓硫酸 防止G中的水蒸气进入E中 碱石灰 ABC 锌粒 残清液 气体未冷却至室温
【解析】由已知结合实验装置图可知,该实验中用浓盐酸与二氧化锰反应生成氯气,会含有氯化氢、水等杂质,须先用饱和食盐水除氯化氢,再用浓硫酸干燥,氯气与铝反应制得氯化铝,用氢氧化钠吸收反应后尾气中的氯气,因为无水氯化铝遇潮湿空气即产生大量白雾,为防止氯化铝与氢氧化钠溶液中的水蒸气反应,所以在收集瓶和尾气吸收装置之间增加干燥装置F。
(1)由上述分析知,装置B中盛放饱和食盐水,目的是为了除去Cl2中混有的HCl气体;因为氯化铝易发生水解,故F的作用应该是防止G中的水蒸气进入E装置,所以F装置中应放浓硫酸,而G是吸收反应剩余的氯气,所以可加入碱石灰来代替F和G的作用。
(2)装置A中用浓盐酸与二氧化锰反应制取氯气,先检查装置气密性,然后往烧瓶中加入MnO2粉末,再从分液漏斗往烧瓶中加入浓盐酸,最后加热,所以操作顺序为ABC。
(3)①因为要测定反应残余液中盐酸的浓度,所以使Y形管中的残余清液与锌粒反应,需保证盐酸反应完全,应将锌粒加入残余清液中;②反应完毕后,每间隔1分钟读取气体体积,气体体积逐渐减小的原因是:该反应放热,气体未冷却至室温,当冷却到室温后,气体体积就不再改变。

【题目】(Ⅰ)工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)已知在某温度和压强下:
①2CO(g)+O2(g)=2CO2(g) △H= -566.0 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H= - 483.6 kJ·mol-1
③2CH3 OH(g)+3O2(g)=2CO2(g)+4H2 O(g) △H= -1275.6 kJ·mol-1
则在相同的温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_________________________________________________________。
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,甲醇的物质的量的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
甲醇/mol | 0 | 0.22 | 0.36 | 0.45 | 0.5 | 0.5 |
则从反应开始到20min时,以CO表示的平均反应速率=_________________,该温度下平衡
常数K=________________,若升高温度则K值__________(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是________________;
A.2 v (H2)正= v (CH3OH)逆 B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变 D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
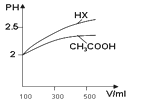
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO)- c(Na+)=________mol·L-1(填精确值)。