题目内容
【题目】中和反应是放热反应。取10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/ml)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 mL稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。
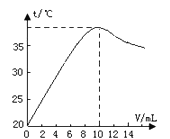
(1)当加入4ml稀盐酸时,烧杯中溶液的溶质为 (写化学式)
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的原因 。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠多少克?(精确到0.1g)
【答案】(1)NaOH NaCl
(2)中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降。
(3)1.6g
【解析】
试题分析:(1)向氢氧化钠溶液中滴入稀盐酸,两者发生反应生成氯化钠和水,当加入4mL时,根据图像反应温度没有达到最高,说明NaOH有剩余,则烧杯中溶液的溶质为NaOH和NaCl。
(2)中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降,所以温度先升高后降低。
(3)解:设生成氯化钠的质量为x
NaOH + HCl = NaCl + H2O
40 58.5
1.1mL×1.1g/mL×10% x
40/( 1.1mL×1.1g/mL×10%)=58.5/x,解得x=1.6g
答:生成氯化钠的质量为1.6g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

