题目内容
判断下列物质在下列变化过程中克服微粒之间的作用力类型:
(1)碘升华________.
(2)氯化钠晶体熔化________.
(3)硫化氢受热分解成硫和氢气________.
(4)电解水生成氢气和氧气________.
(5)水汽化生成水蒸气________.
(6)乙醇挥发________.
答案:
解析:
解析:
|
答案:(1)分子间作用力 (2)离子键 (3)共价键 (4)共价键 (5)分子间作用力 (6)分子间作用力 解析:首先判断各种变化是物理变化还是化学变化,(1)(2)(5)(6)是物理变化,(3)(4)是化学变化.然后判断发生物理变化的是分子晶体还是离子晶体,晶体发生变化时破坏的是分子间作用力还是化学键. |

练习册系列答案
相关题目
 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据: NH3?HDO+D+
NH3?HDO+D+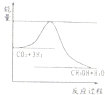
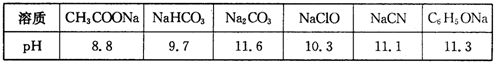
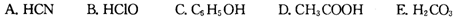
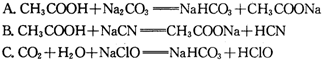

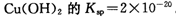 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里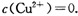
 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
 ,混合气体平均相对分子质量为 。
,混合气体平均相对分子质量为 。
 (2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。