题目内容
【题目】已知化合物A与B、丙与丁的元素组成相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D为应用最广泛的金属,且D与甲的浓溶液在常温作用无明显现象,加热时有大量气体产生。(相关转化部分反应条件和生成物未标出)。
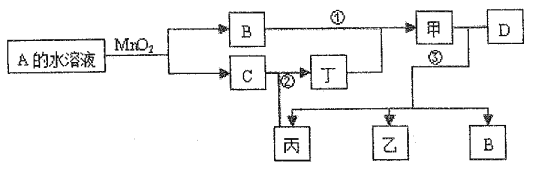
注:转化关系中,②表示C与丙反应生成丁。
(I)反应中MnO2的作用为_____,有1molA完全反应生成B、C转移____mol电子;
(II)若反应①除生成甲外,还生成丙,回答(1)、(2)小题:
(1)反应②的化学方程式:_______________。
(2)写出过量D与甲的稀溶液反应的离子方程式:____________。
(III)若丙为无色有刺激性气味的气体,可以使品红溶液褪色,回答(3)、(4)小题:
(3)写出下列化学方程式②:__________________;③(甲足量):_________________。
(4)检验乙溶液中离子的实验方法为______________。
【答案】 催化剂 1 2NO+O2==2NO2 3Fe+8H++2NO3-==3Fe2++2NO↑+4H2O 2SO2+O2![]() 2SO3 2Fe+6H2SO4(浓)
2SO3 2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+3H2O Fe3+:取样于一干净试管中,加入少量KSCN溶液,溶液变红;SO42-:取样,先加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀
Fe2(SO4)3+3SO2↑+3H2O Fe3+:取样于一干净试管中,加入少量KSCN溶液,溶液变红;SO42-:取样,先加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀
【解析】化合物A与B在常温下均呈液态,由图中转化关系可知,A为H2O2、B为H2O、C为O2,D为应用最广泛的金属,D为Fe,Fe与甲的浓溶液在常温下无明显现象,加热时有大量气体产生,甲可能为硫酸或硝酸。
(I). H2O2在MnO2催化作用下分解生成水和O2,MnO2的作用为催化剂,反应的化学方程式为2H2O2![]() 2H2O+O2↑,在该反应中,氧元素的化合价部分从-1价升高到0价,部分从-1价降低到-2价,1molH2O2完全反应时转移电子1mol,故答案为:催化剂;1;
2H2O+O2↑,在该反应中,氧元素的化合价部分从-1价升高到0价,部分从-1价降低到-2价,1molH2O2完全反应时转移电子1mol,故答案为:催化剂;1;
(II). (1). 若反应①除生成甲外,还生成丙,则甲为硝酸、丙为NO、丁为NO2、乙为Fe(NO3)2或Fe(NO3)3,反应②为NO和O2反应生成NO2,化学方程式为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;
(2). 过量的Fe与稀硝酸反应生成Fe(NO3)2、NO和H2O,离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(III). (3). 若丙为无色有刺激性气味的气体,可以使品红溶液褪色,则甲为硫酸、丙为SO2、丁为SO3、乙为Fe2(SO4)3,反应②为SO2和O2在催化剂作用下加热反应生成SO3,化学方程式为2SO2+O2![]() 2SO3,反应③为足量的浓硫酸与Fe反应生成硫酸铁、二氧化硫和水,化学方程式为2Fe+6H2SO4(浓)
2SO3,反应③为足量的浓硫酸与Fe反应生成硫酸铁、二氧化硫和水,化学方程式为2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+3H2O,故答案为:2SO2+O2
Fe2(SO4)3+3SO2↑+3H2O,故答案为:2SO2+O2![]() 2SO3;2Fe+6H2SO4(浓)
2SO3;2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+3H2O;
Fe2(SO4)3+3SO2↑+3H2O;
(4). 乙为Fe2(SO4)3溶液,Fe3+的检验方法为:取少量乙溶液置于一干净试管中,加入少量KSCN溶液,溶液变红,说明含有Fe3+;SO42-的检验方法为:取少量乙溶液置于一干净试管中,先加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀生成,说明含有SO42-,故答案为:Fe3+ :取样于一干净试管中,加入少量KSCN溶液,溶液变红;SO42-:取样,先加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀。