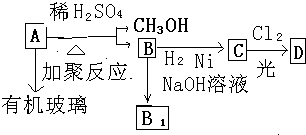
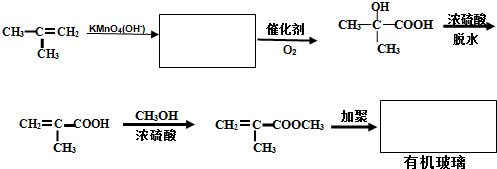
题目内容
15.NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | 2.8g铁与0.05mol Cl2充分反应,转移0.15NA电子 | |
| B. | 27g Al与足量NaOH溶液反应生成 33.6L H2 | |
| C. | 14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA | |
| D. | 0.1mol Na2O2与足量二氧化碳反应转移0.2NA个电子 |
分析 A.2.8gFe的物质的量为0.05mol,0.05mol铁完全反应消耗0.15mol氯气,氯气不足,需要根据氯气的物质的量计算转移的电子数;
B.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.乙烯和丙烯的最简式为CH2,根据最简式计算出混合物中含有的原子数;
D.0.1mol过氧化钠与二氧化碳完全反应生成0.05mol氧气,过氧化钠中氧元素的化合价为-1价,据此计算出转移的电子数.
解答 解:A.2.8gFe的物质的量为:$\frac{2.8g}{56g/mol}$=0.05mol,0.05mol铁完全反应消耗0.15mol氯气,氯气不足,0.05mol Cl2充分反应转移了0.1mol电子,转移0.1NA电子,故A错误;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算生成氢气的体积,故B错误;
C.14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有14g最简式CH2,含有最简式CH2的物质的量为1mol,1mol最简式CH2中含有3mol原子,含有原子的数目为3NA,故C正确;
D.0.1mol过氧化钠与二氧化碳完全反应生成氧气的物质的量为0.05mol,Na2O2中氧元素的化合价为-1价,则生成0.05mol氧气转移了0.1mol电子,转移l0.1NA个电子,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意没有告诉在标准状况下.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.既能跟盐酸反应又能跟氢氧化钠溶液反应的物质是( )
| A. | NH4Cl | B. | Al(OH)3 | C. | Na2CO3 | D. | AlCl3 |
20.实验室可用K2Cr2O7固体与浓盐酸混合加热制备氯气.发生的离子反应如下:____Cr2O72-+____Cl-+____H+=____Cl2↑+____Cr3++____□,下列有关叙述不正确的是( )
| A. | 以上各物质对应的计量数依次为1、6、14、3、2、7 | |
| B. | Cr2O72-发生了还原反应 | |
| C. | □处对应的物质是H2O | |
| D. | 若0.1mol Cr2O72-参加反应,产生氯气物质的量是0.5mol |
7.下列化学用语使用正确的是( )
| A. | NH4Cl的电子式: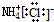 | |
| B. | 氯离子的结构示意图: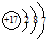 | |
| C. | 乙酸的结构简式:CH3COOH | |
| D. | 硫酸的电离方程式:H2SO4=H++SO42- |
5.下列仪器能直接用于加热的是( )
| A. | 烧杯 | B. | 量筒 | C. | 坩埚 | D. | 容量瓶 |
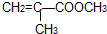 不溶于水,并可以发生以下变化:
不溶于水,并可以发生以下变化: