题目内容
下列各组离子在溶液中能够大童共存,当溶液中的pH=1时,有气体产生;而当溶液中的pH=13时,又能生成沉淀。则该组离子可能是:
| A.Na+、K+、AlO2-、CO32- | B.Fe2+、Na+、SO42-、NO3- |
| C.Mg2+、NH4+、CO32-、Cl- | D.Ba2+、K+、Cl-、MnO4- |
B
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A、离子间可以大量共存,如果溶液显酸性,则产生CO2气体;溶液显碱性,不能产生沉淀,A不正确;B、离子间可以大量共存,如果溶液显酸性,则NO3-氧化Fe2+,产生NO2气体;如果溶液显碱性,则产生氢氧化亚铁沉淀,沉淀最终变为氢氧化铁沉淀,B正确;C、Mg2+与CO32-不能大量共存,二者产生碳酸镁沉淀,C不正确;D、Cl-、MnO4-不能大量共存,二者发生氧化还原反应,D不正确,答案选B。
考点:考查离子共存的正误判断

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH =2CH3COO-+H2O+CO2↑ | 错误,碳酸钙是弱电解质,不拆写 |
| B | Ba(HCO3)2溶液中通入过量NaOH溶液 | Ba2++HCO3-+OH-=BaCO3↓+H2O | 正确 |
| C | 碳酸氢钠的水解 | HCO3-+H2O OH-+H2CO3 OH-+H2CO3 | 正确 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Cl2=2Fe3++4Cl- | 正确 |
下列离子方程式书写正确的是
| A.铁溶于稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| B.二氧化硫与足量烧碱溶液反应:S02+20H-=S032-+H20 |
| C.醋酸溶液与氢氧化钠溶液反应:H++OH-=H20 |
D.浓盐酸与MnO2反应制Cl2:Mn02+2H++2C1- C12↑+Mn2++H20 C12↑+Mn2++H20 |
下列图示与对应的叙述相符的是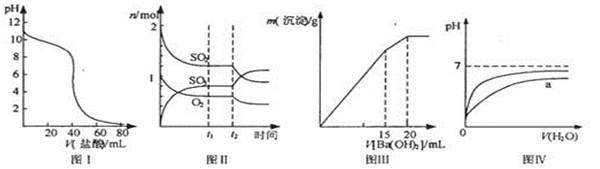
| A.图I表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B.图II表示一定条件下进行的反应2SO2 +O2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
| C.图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图IV表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应 的是盐酸 |
在pH=1的无色溶液中,下列各离子组因发生氧化还原反应而不能共存的是
| A.NH4+ K+ Na+ CO32- NO3- |
| B.K+ Na+ Fe2+ SO42- NO3- |
| C.NH4+ K+ Na+ HCO3-[Al(OH)4]- |
| D.NH4+ K+ Na+ NO3- I- |
下列叙述不正确的是
| A.易溶于水的物质一定是电解质 |
| B.有化学键断裂的变化不一定是化学变化 |
| C.溶解于水所得溶液能导电的物质不一定是电解质 |
| D.水受热不易分解,与水分子之间存在的氢键无关 |
下列物质的水溶液能导电,但属于非电解质的是
| A.NH3 | B.Cl2 | C.C2H5OH | D.CH3COOH |
下列离子方程式正确的是
| A.大理石溶于醋酸: CaCO3+2H+ =Ca2+ + CO2 ↑ +H2O |
| B.FeBr2溶液中通入少量的Cl2: Cl2+2Fe2+=2Fe3+ +2Cl- |
| C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42- +Ba2+ +2OH- = BaSO4 ↓+ ↑2H2O |
| D.酸性氢氧燃料电池的正极反应: H2-2e- = 2H+ |