题目内容
13.化学与科学、技术、生活、环境密切相关,下列叙述正确的是( )| A. | 氢氧化铝可作胃酸过多的中和剂 | |
| B. | 为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
分析 A.氢氧化铝为难溶物,能够中和胃酸中的盐酸;
B.注意氧化还原反应的实质,食品被氧化的实质是被空气中的氧气氧化;
C.食品类物质中所含有的碘、氟、硒、钙、铁等均指元素;
D.胶体中分散质粒度介于1-100nm.
解答 解:A.氢氧化铝能够与胃酸中的盐酸反应,能够作胃酸的中和剂,故A正确;
B.生石灰无还原性不能与氧化性物质反应,故不能防止食品氧化,故B错误;
C.这里的碘、氟、硒、钙、铁存在于无机盐中,是指元素,故C错误;
D.PM2.5颗粒物直径接近2.5微米,不在1nm-100nm之间,不属于胶体,故D错误.
故选A.
点评 本题考查抗酸药、食品添加剂、元素以及环境污染等,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
4.如下a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物,下列有关说法不正确的是( )
a$→_{一定条件}^{HBr}$b$\stackrel{NaOH溶液}{→}$c$→_{△}^{O_{2}(Cu)}$d$→_{②H+}^{①银氨溶液}$e$→_{浓硫酸△}^{+c}$f.
a$→_{一定条件}^{HBr}$b$\stackrel{NaOH溶液}{→}$c$→_{△}^{O_{2}(Cu)}$d$→_{②H+}^{①银氨溶液}$e$→_{浓硫酸△}^{+c}$f.
| A. | 若a的相对分子质量是42,则d是丙醛 | |
| B. | 若d的相对分子质量是44,则a是乙炔 | |
| C. | 若a为苯乙烯(C6H5-CH=CH2),则f的分子式是C16H16O2 | |
| D. | 若a为单烯烃,则d与f的最简式一定相同 |
8.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g)不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 体系的压强不再发生变化 | |
| B. | V正(CO)=V逆(H2O) | |
| C. | 体系的气体的密度和平均相对分子质量不再发生变化 | |
| D. | 1 mol H-H键断裂的同时生成2 mol H-O键 |
18.下列各项中仪器可能完成目的实验的是( )
| 选项 | 仪器 | 实验 |
| A | 制取蒸馏水 | 圆底烧瓶、冷凝管、锥形瓶、温度计、牛角管 |
| B | 由98%的浓硫酸配制250ml 1.5mol/L的稀硫酸 | 250mol容量瓶、量筒、胶头滴管、玻璃棒 |
| C | 实验室用MnO2与浓盐酸制取并收集氯气 | 酒精灯、铁架台(带铁夹、铁圈)、圆底烧瓶、导管、集气瓶 |
| D | 测定NaCl中混有KCl | 烧杯、玻璃棒、酒精灯、蓝色钴玻璃、铂丝 |
| A. | A | B. | B | C. | C | D. | D |
3.Ⅰ、实验室里用图1所示的装置制无水CuCl2,根据图示回答下列问题:

(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况: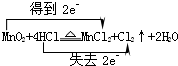 .
.
(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.

(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况:
 .
.(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.
| 实验操作 | 实验现象 | 结 论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | 假设①成立 |
| 溶液不变红 | 假设②成立 |
20.已知,T℃时2A(g)+B(g)?2C(g)△H=-akJ/mol(a>0),在甲、乙、丙三个容积均为2L的恒容密闭容器中投入A(g)和B(g),经5min达到平衡.其起始物质的量及A的平衡转化率如表所示.
下列判断中,错误的是( )
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | |
| A的平衡转化率 | 80% | α1 | α2 | |
| A. | 甲从开始到平衡时ν(A)为0.032mol•L-1•min-1 | |
| B. | 平衡时,A的转化率:α1<80%<α2 | |
| C. | T℃时,平衡常数K=400L/mol | |
| D. | 绝热容器中,压缩体积,平衡常数K>400 L/mol |
1.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 加入甲基橙试液呈红色的溶液 NH4+,K+,SO42-,Cl- | |
| B. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| C. | Na2S溶液中 SO42-、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 NO3-、I-、Na+、Al3+ |
 CH2CH3 B.
CH2CH3 B. 与
与 C.
C. D.CH3CH2C≡CH与CH2=CH-CH=CH2 E.
D.CH3CH2C≡CH与CH2=CH-CH=CH2 E. 与
与