题目内容
(2010?崇文区一模)下列各组溶液中,只用括号内的试剂及物质间相互反应无法鉴别的一组是( )
分析:A.FeCl3溶液可检验Ba(OH)2和KSCN,然后用Ba(OH)2检验K2SO4;
B.硫酸与四种物质反应的显现各不相同;
C.AgNO3溶液不能鉴别HCl和CaCl2;
D.KOH溶液与四种物质反应的现象各不相同.
B.硫酸与四种物质反应的显现各不相同;
C.AgNO3溶液不能鉴别HCl和CaCl2;
D.KOH溶液与四种物质反应的现象各不相同.
解答:解:A.FeCl3溶液可检验Ba(OH)2和KSCN,现象分别为沉淀和溶液呈红色,然后用Ba(OH)2检验K2SO4,生成沉淀,故A不选;
B.加入硫酸,NaNO3无现象;NaHCO3生成无色无味气体,Na2SO3生成刺激性气体,Na2SiO3生成沉淀,可鉴别,故B不选;
C.AgNO3溶液不能鉴别HCl和CaCl2,二者都生成白色沉淀,故C选;
D.加入KOH溶液,NH4Cl生成刺激性气体,Mg(NO3)2生成白色沉淀,CuSO4生成蓝色沉淀,AlCl3先生成沉淀,KOH过量沉淀溶解,可鉴别,故D不选.
故选C.
B.加入硫酸,NaNO3无现象;NaHCO3生成无色无味气体,Na2SO3生成刺激性气体,Na2SiO3生成沉淀,可鉴别,故B不选;
C.AgNO3溶液不能鉴别HCl和CaCl2,二者都生成白色沉淀,故C选;
D.加入KOH溶液,NH4Cl生成刺激性气体,Mg(NO3)2生成白色沉淀,CuSO4生成蓝色沉淀,AlCl3先生成沉淀,KOH过量沉淀溶解,可鉴别,故D不选.
故选C.
点评:本题考查物质的检验和鉴别,题目难度不大,注意把握物质的性质,鉴别物质要产生不同的现象.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
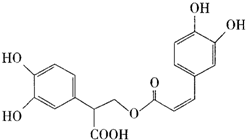 (2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )
(2010?崇文区一模)迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如图所示.下列叙述正确的是( )

