题目内容
下列说法正确的是
- A.可逆反应在其他条件不变时,升高温度,可以减小反应的活化能,加快反应速率
- B.S电子云是球形对称的,P电子云是纺锤形,电子云中每个小黑点代表一个电子
- C.氮原子的第一电离能低于氧原子的第一电离能,因为氮比氧非金属性弱
- D.Fe3+比Fe2+稳定,因为Fe3+价电子构型是3d5,d亚层处于半充满状态,稳定
D
试题分析:可逆反应在其他条件不变时,升高温度,可以增大活化分子的百分数,加快反应速率,A错;S电子云是球形对称的,P电子云是纺锤形,电子云中每个小黑点代表电子出现的几率,B错;氮原子的第一电离能低于氧原子的第一电离能,这个根据结构化学来解释。氮的结构是1S2 2S2 2P3。P轨道正好为半满结构,比碳和氧都稳定。然后还要注意除了第五主族和第六主族,第二主族和第三主族也会出现电能不规则排布。C错。故选D。
考点:结构化学中的原子、离子的电子排布规律
点评:熟练掌握原子、离子的电子排布规律,尤其是半满,全满的离子排布给离子带来的特殊性质。
原子核外电子排布有3大原则1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对。
2、能量最低原理:电子尽可能占据能量最低的轨道
3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的:全充满---p6或d10或f14半充满----p3或d5或f7
Ni的基态原子外围电子(价电子)排布为3d84s2符合半满全满规则,而离子外围就是全满的所以满足的,很稳定。
试题分析:可逆反应在其他条件不变时,升高温度,可以增大活化分子的百分数,加快反应速率,A错;S电子云是球形对称的,P电子云是纺锤形,电子云中每个小黑点代表电子出现的几率,B错;氮原子的第一电离能低于氧原子的第一电离能,这个根据结构化学来解释。氮的结构是1S2 2S2 2P3。P轨道正好为半满结构,比碳和氧都稳定。然后还要注意除了第五主族和第六主族,第二主族和第三主族也会出现电能不规则排布。C错。故选D。
考点:结构化学中的原子、离子的电子排布规律
点评:熟练掌握原子、离子的电子排布规律,尤其是半满,全满的离子排布给离子带来的特殊性质。
原子核外电子排布有3大原则1、Pauli不相容原理:每个轨道最多只能容纳两个电子,且自旋相反配对。
2、能量最低原理:电子尽可能占据能量最低的轨道
3、Hund规则:简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子另外:等价轨道在全充满、半充满或全空的状态是比较稳定的,亦即下列电子结构是比较稳定的:全充满---p6或d10或f14半充满----p3或d5或f7
Ni的基态原子外围电子(价电子)排布为3d84s2符合半满全满规则,而离子外围就是全满的所以满足的,很稳定。

练习册系列答案
相关题目
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题.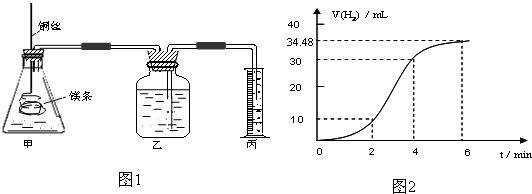
(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是 .(填代号)
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为 .(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
①上表中V1= mL,V3= mL.
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是 .
③若实验测得t2>t3>t4,则可得出的实验结论是 .

(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO2与H2O2反应速率的影响
已知MnO2+H2O2+2H+═Mn2++O2↑+2H2O,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是
③若实验测得t2>t3>t4,则可得出的实验结论是


 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.