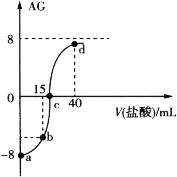
��Ŀ����
����Ŀ���й�����֮���ת����ϵ��ͼ��ijЩ��Ӧ�IJ������ʺͷ�Ӧ��������ȥ����֪X��Y��Z���ճ������г����������ʣ�X�ɵؿ��к�����ߵĽ���Ԫ����ɡ�A�Ǻ�ˮ�к��������Σ�B�dz�������ɫҺ�壬D��E�dz�����̬�ǽ������ʣ�����D�ʻ���ɫ��F��ϡ��Һ����ɫ��
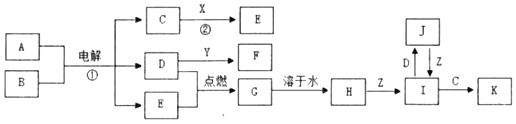
��ش��������⣺
(1)�Է�Ӧ��Ϊԭ���Ĺ�ҵ����Ϊ_____��ҵ��
(2)K�Ļ�ѧʽΪ_____��
(3)��Ӧ�ڵ����ӷ���ʽΪ_____��
(4)J��Y��Ӧ�Ļ�ѧ����ʽΪ_____��
���𰸡��ȼ� Fe(OH)2 2Al+2OH��+2H2O��2AlO2��+3H2�� Cu+2FeCl3��CuCl2+2FeCl2
��������
X��Y��Z���ճ������г����������ʣ�X�ɵؿ��к�����ߵĽ���Ԫ����ɣ���XΪAl��D��E�dz�����̬�ǽ������ʣ�����D�ʻ���ɫ����DΪCl2��D��Y��Ӧ�õ�F����F��ϡ��Һ����ɫ����F����Cu2������YΪCu��FΪCuCl2��A�Ǻ�ˮ�к��������Σ���AΪNaCl��B�dz�������ɫҺ�壬�ҵ��A��B�����õ�C��D����������E����BΪH2O�����嵥��EΪH2��CΪNaOH����ת����ϵ��֪��GΪHCl��HΪ���ᡣ���������Z��Ӧ�õ�I��I�ܱ����������õ�J������ZΪ��۽���������֪ZΪFe����IΪFeCl2��JΪFeCl3��KΪFe��OH��2 ��
(1)��Ӧ��Ϊ����Ȼ�����Һ���Է�Ӧ��Ϊԭ���Ĺ�ҵ����Ϊ�ȼҵ���ʴ�Ϊ���ȼ
(2)�ɷ�����֪��K�Ļ�ѧʽΪ��Fe(OH)2���ʴ�Ϊ��Fe(OH)2��
(3)��Ӧ����Al��NaOH��Һ�ķ�Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O��2AlO2��+3H2�����ʴ�Ϊ��2Al+2OH��+2H2O��2AlO2��+3H2����
(4)J��Y��Ӧ�Ļ�ѧ����ʽΪ��Cu+2FeCl3��CuCl2+2FeCl2���ʴ�Ϊ��Cu+2FeCl3��CuCl2+2FeCl2��

����Ŀ����������ʵ��������������ó��Ľ�����ȷ���ǣ� ��
ʵ����� | ���� | ���� | |
A | ����ˮ�еμ������ữ��AgNO3��Һ | ������ɫ���� | ��ˮ�к���Cl�� |
B | ��ij��Һ�еμ����� | ����ɫ������� | ��Һ��һ����CO32�� |
C | ��ij��Һ�м����ռ���Һ����ȣ���ʪ��ĺ�ɫʯ����ֽ���� | ʯ����ֽ���� | ��Һ����NH4+ |
D | ��SO2ͨ�뵽����KMnO4��Һ�� | ��Һ�Ϻ�ɫ��ȥ | SO2����Ư���� |
A.AB.BC.CD.D