��Ŀ����
����Ŀ��I.ij�о���ѧϰС��Ϊ����ȡ���ռ����������������̽�����������ʣ������������ͼ��ʾ��ʵ��װ�ã�
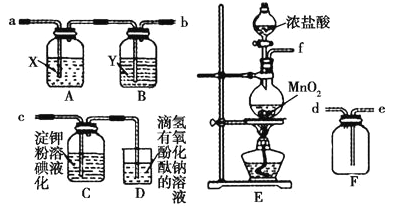
��ش��������⣺
��1������ʵ��װ�õ�����˳����f��_____��_____��____(����ӿڴ�����ĸ����)��
��2��Eװ������ȡ���������ӷ���ʽ��___________________��
��3��Aװ�����Լ�X��___________________��
��4��Cװ���е�������________�������������ԭ����____________(�����ӷ���ʽ�ͱ�Ҫ�����ֽ���)��
II.�����Ͻ����κ��Է���������ԭ��Ӧ��������Ƴ�ԭ��ء������÷�Ӧ��Cu+2Ag+��2Ag+Cu2+������һ����ѧ���(����������̼��)���ش��������⣺
��1���õ��ѡ��ĵ������Һ��______________(�ѧʽ)��
��2�������缫��Ӧ�����ӷ���ʽ��____________________��
��3����������ת�Ƶ���1mol����������������Ϊ_________��
���𰸡� a��b��e��d��c MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O ����ʳ��ˮ ��Һ����ɫ 2I-+Cl2=I2+2C1- ����������� AgNO3 Ag++e-=Ag 108g
Mn2++Cl2��+2H2O ����ʳ��ˮ ��Һ����ɫ 2I-+Cl2=I2+2C1- ����������� AgNO3 Ag++e-=Ag 108g
��������I.��1�����ɵ������к����Ȼ����ˮ�������ռ�֮ǰ��Ҫ���������ñ���ʳ��ˮ��ȥ�Ȼ��⣬Ũ������������������ܶȴ��ڿ��������������ſ������ռ�������������Ҫβ��������������ʵ��װ�õ�����˳����f��a��b��e��d��c����2��Eװ������ȡ���������ӷ���ʽ��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O����3���������Ϸ�����֪Aװ�����Լ�X�DZ���ʳ��ˮ����4�������ܰѵ⻯���������ɵ��ʵ⣬������������ɫ����Cװ���е���������Һ����ɫ����Ӧ�����ӷ���ʽΪ2I-+Cl2=I2+2C1-��
Mn2++Cl2��+2H2O����3���������Ϸ�����֪Aװ�����Լ�X�DZ���ʳ��ˮ����4�������ܰѵ⻯���������ɵ��ʵ⣬������������ɫ����Cװ���е���������Һ����ɫ����Ӧ�����ӷ���ʽΪ2I-+Cl2=I2+2C1-��
II.��1�����ڷ�Ӧ�������ӵõ����ӣ���õ��ѡ��ĵ������Һ�ǿ��������Σ�����AgNO3����2�����������ӵõ����ӣ��缫��Ӧ�����ӷ���ʽ��Ag++e-=Ag����3����������ת�Ƶ���1mol������ݵ缫��Ӧʽ��֪������������Ϊ1mol��108g/mol��108g��

