题目内容
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、常温下,Cu-Zn原电池中,正极产生1.12L H2时,转移的电子数应为0.1NA |
| B、12g金刚石中含有的共价键数为4NA |
| C、2g D2O中所含中子数为NA |
| D、常温下,1L 0.1mol/L Na2CO3溶液中,含有CO32-数为0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氢气的物质的量;
B.金刚石中,每个C原子与其它4个C形成了4个C-C共价键,根据均摊法,每个碳原子形成共价键的数目为:
×4=2,据此计算出1mol碳原子形成的共价键数目;
C.D2O的摩尔质量为20g/mol,分子中含有10个中子,2g该水的物质的量为0.1mol,含有2mol中子;
D.碳酸钠溶液中,碳酸根离子部分水解,导致溶液中碳酸根离子数目减少.
B.金刚石中,每个C原子与其它4个C形成了4个C-C共价键,根据均摊法,每个碳原子形成共价键的数目为:
| 1 |
| 2 |
C.D2O的摩尔质量为20g/mol,分子中含有10个中子,2g该水的物质的量为0.1mol,含有2mol中子;
D.碳酸钠溶液中,碳酸根离子部分水解,导致溶液中碳酸根离子数目减少.
解答:
解:A.不是标准状况下,题中条件无法计算1.12L氢气的物质的量,故A错误;
B.金刚石为原子晶体,晶体中每个C原子与其它4个C形成了4个C-C共价键,根据均摊法,每个碳原子形成共价键的数目为:
×4=2,12g金刚石中含有1mol碳原子,1molC能够形成2mol共价键,含有的共价键数为2NA,故B错误;
C.2.0g重水的物质的量为0.1mol,0.1mol重水中含有1mol中子,所含中子数为NA,故C正确;
D.1L 0.1mol/L Na2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子水解,溶液中碳酸根离子小于0.1mol,含有CO32-数小于0.1NA,故D错误;
故选C.
B.金刚石为原子晶体,晶体中每个C原子与其它4个C形成了4个C-C共价键,根据均摊法,每个碳原子形成共价键的数目为:
| 1 |
| 2 |
C.2.0g重水的物质的量为0.1mol,0.1mol重水中含有1mol中子,所含中子数为NA,故C正确;
D.1L 0.1mol/L Na2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子水解,溶液中碳酸根离子小于0.1mol,含有CO32-数小于0.1NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
用一种试剂可将三种无色液体:四氯化碳、苯、二甲苯鉴别出来,该试剂是( )
| A、酸性高锰酸钾溶液 | B、溴水 |
| C、硫酸 | D、水 |
下列关于氢键的说法正确的是( )
| A、由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3 |
| B、氢键只能存在于分子间,不能存在于分子内 |
| C、在固态水(冰)中,水分子间氢键数目增多,造成体积膨胀,密度减小 |
| D、相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多 |
氰气的化学式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )
| A、在一定条件下可发生加成反应 |
| B、分子中N≡C键的键长大于C-C键的键长 |
| C、分子中含有2个σ键和4个π键 |
| D、不和氢氧化钠溶液发生反应 |
下列反应属于取代反应的是( )
| A、丙烯与氯化氢在一定条件下制取2-氯丙烷 |
| B、酒精与浓硫酸混合液迅速升温至170℃的反应 |
| C、甲烷制四氯化碳 |
| D、甲烷与氧气的混合气体在点燃下的反应 |
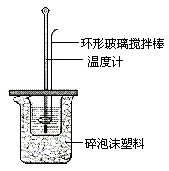 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题