题目内容
(1)pH=2的盐酸溶液中,水电离出的c(H+)为多少?
(2)在25℃时,某溶液中,由水电离出的c(H+)=10-12mol/L,则该溶液的pH可能是多少?
解析:
|
(1)10-12mol/L;(2)12或2 【巧解导析】这是一道有关溶液中水的电离的题目.第(1)问盐酸溶液的pH=2,此时溶液中的c(H+)=10-2mol/L,但水电离出的c(H+)并不等于10-2mol/L.因为盐酸的电离远远大于水的电离,水电离出的c(H+)与盐酸电离出的c(H+)相比微乎其微,一般忽略不计,溶液的c(H+)实际为盐酸电离出的c(H+).那是否无法求算水电离出的c(H+)呢?不是的.盐酸溶液中的OH-来自于水的电离,H2O 第(2)问,水电离出的c(H+)必然等于水电离出的c(OH-)为10-12mol/L,如果是酸的溶液,溶液的c(H+)实际为酸电离出的c(H+)远大于水电离出的c(H+),但溶液的c(OH-)为水电离出的c(OH-),等于10-12mol/L,所以溶液的c(H+)=10-2mol/L,pH=2.如果是碱的溶液,溶液的c(OH-)实际为碱电离出的c(OH-),远大于水电离出的c(OH-),但溶液的c(H+)为水电离出的c(H+),等于10-12mol/L,所以pH=12. |
提示:
|
【巧解点悟】在任何溶液中,水都会发生微弱的电离H2O |

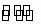 H++OH-,水电离出的c(H+)等于它所电离出的c(OH-),也就是溶液中的c(OH-),溶液中的c(H+)·c(OH-)=1×10-14,可求出水电离出的c(H+)=c(OH-)=10-12mol/L.
H++OH-,水电离出的c(H+)等于它所电离出的c(OH-),也就是溶液中的c(OH-),溶液中的c(H+)·c(OH-)=1×10-14,可求出水电离出的c(H+)=c(OH-)=10-12mol/L.