题目内容
13.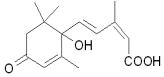 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A. | 含有碳碳双键、羟基、羰基、苯环、羧基 | |
| B. | 该有机物的分子式为C15H20O4 | |
| C. | 分子中所有的原子有可能在同一平面 | |
| D. | 该有机物属于芳香族化合物 |
分析 由结构可知分子式,分子中含碳碳双键、-OH、-COOH及羰基,不含苯环,且甲基、亚甲基均为四面体构型,以此来解答.
解答 解:A.分子中不含苯环,故A错误;
B.由结构可知分子式为C15H20O4,故B正确;
C.分子中甲基、亚甲基均为四面体构型,则所有原子不可能共面,故C错误;
D.不含苯环,不属于芳香族化合物,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团、结构、类别为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
11.不能通过化合反应得到的是( )
| A. | NH4Cl | B. | Cu2S | C. | FeCl2 | D. | Al(OH)3 |
4.某温度下,在100g水中加入50g NaCl固体,搅拌使其充分溶解后过滤,得到136g滤液,则( )
| A. | 滤液为NaCl饱和溶液 | B. | 滤液中NaCl的质量分数为36% | ||
| C. | 该温度下,NaCl的溶解度为50g | D. | 该温度下,NaCl的溶解度为36g |
1.中学化学中所学很多“规律”都有其特定的使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据周期元素的原子半径变化趋势,推出Al的半径比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据同主族元素化学性质相似规律,推出Li在空气中完全燃烧的产物是Li2O2 | |
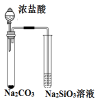
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入Na2SiO3溶液中能生成H2SiO3 |
8.不能说明金属性Na>Mg>Al的是( )
| A. | 原子半径Na>Mg>Al | |
| B. | 碱性NaOH>Mg(OH)2>Al (OH)3 | |
| C. | 阳离子的氧化性Na+<Mg2+<Al3+ | |
| D. | Na与冷水剧烈反应,Mg与冷水反应微弱;镁粉与铝粉分别与同浓度稀HCl反应,镁粉比铝粉反应剧烈 |
18.环丙烷叉环丙烷结构为: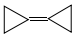 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 不可能是环丙烷的同系物 | ||
| C. | 与环己二烯(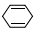 )是同分异构体 )是同分异构体 | D. | 所有的原子均在同一平面内 |
5.X、Y、Z、W四种短周期元素,化合物XZ可刻蚀玻璃,Y元素原子的最外层电子数是内层电子数的3倍,W+与Z的简单离子有相同的电子层排布.下列说法正确的是( )
| A. | 气态氢化物的热稳定性:Y>Z | |
| B. | W与另外三种元素均可形成离子键 | |
| C. | 简单离子半径:W>Y>Z | |
| D. | W和Y可形成阴阳离子个数比是1:1的化合物 |
3. 中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )
中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )
 中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )
中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如图转化关系(部分反应物、生成物和反应条件略去).下列推断不正确的是( )| A. | 若D为白色沉淀,且与A的摩尔质量相等,则X一定是铝盐 | |
| B. | 若A是单质,B和D的反应是OH-+HCO3-═H2O+CO32-,则E一定能还原CuO | |
| C. | 若B、X均为单质,D为CO,C能和E反应,则E为NaOH | |
| D. | 若X是Na2SO3,C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应 |