题目内容
【题目】将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是 ( )
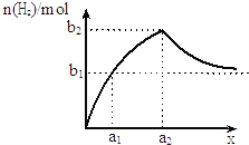
A.a1=![]() B.a2=1C.b1=
B.a2=1C.b1= ![]() D.b2=
D.b2=![]()
【答案】A
【解析】
发生反应有:2Na + 2H2O = 2NaOH + H2 ↑,2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑,开始时铝过量,随着x增大,即钠的量逐渐增大,生成氢气的量开始时会逐渐增大,钠、铝的物质的量相等时,即a2 = 1,生成氢气的量达到增大,之后随着钠的量的增加;生成氢气的量会逐渐减小,成氢气的物质的量,据此进行解答。
A、根据分析可以知道,a1时铝过量,生成氢气量b1与全部是钠时生成的氢气量是一样
的,由此求得![]() ,
,
设钠的物质的量为y mol,此时铝过量,结合反应方程式可以知道参加反应的铝的物质
的量也是ymol,根据电子守恒可得:0.5y + 1.5y = ![]() ,计算得出:
,计算得出:![]() ,
,
则混合物中铝的物质的量为: ,
,
则![]() ,故A错误;
,故A错误;
B、根据分析可以知道,当铝和钠的物质的量相等时,生成氢气的量最大,此时a2 = 1,故B正确;
C、当1.0 g完全为钠时,生成氢气的量为![]() ,故C正确;
,故C正确;
D、当钠和铝的物质的量相等时,生成氢气的量为b2,设此时铝和钠的物质的量
都是x mol,则![]() ,计算得出:x = 0.02,则生成氢气的物质的量为:
,计算得出:x = 0.02,则生成氢气的物质的量为:![]() ,故D正确;
,故D正确;
答案为A。

【题目】下表为元素周期表的局部X、Y、Z、W均为短周期元素,其原子序数之和为47:
X | |||||
Y | Z | W |
(1)X、Y、Z、W的元素符号依次为_______、________、_______、__________(以下所有问题均用元素符号回答);
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为_____;将该化合物的固体溶于足量W的气态氢化物水溶液中,生成两种盐该反应的离子方程式为______________,生成的两种盐的电子式为__________、_____________;
(3)Z的氧化物为_________(填酸性、碱性、两性、不成盐)氧化物,Y、Z、W的最高价氧化物对应的水化物两两之间反应的化学方程式为:![]() __________________________________;
__________________________________;![]() ___________________________;
___________________________;![]() ________________________.
________________________.