题目内容
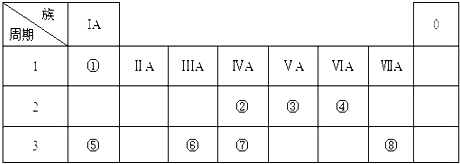
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
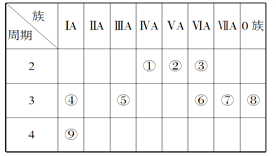
(1)在这些元素中,化学性质最不活泼的是________(填元素符号),②位于元素周期表的第____纵行。
(2)在最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大为___________________。(用序号表示)
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为__________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同
B.③的简单氢化物比⑥的简单氢化物稳定
C.③的简单氢化物的沸点比⑥的简单氢化物的沸点高
D.③的单质能与⑥的简单氢化物反应生成⑥
【答案】 Ar 15 ![]() 高 ⑤<④<⑦<⑥
高 ⑤<④<⑦<⑥  共价 1:2 BD
共价 1:2 BD
【解析】试题分析:由表中信息可知,①②③④⑤⑥⑦⑧⑨分别代表C、N、O、Na、Al、S、Cl、Ar、K等元素。
(1)在这些元素中,化学性质最不活泼的是Ar,②位于元素周期表的第15纵行。
(2)在最高价氧化物的水化物中,碱性最强的化合物是KOH,其电子式是![]() 。
。
(3)钠和钾是同一主族的金属,其价电子数相同,钠离子半径较小,所以,钠的金属键强于钾,故钠的熔点比钾高;④⑤⑥⑦的简单离子分别是Na+、Al3+、S2-、Cl-,前两者核外有2个电子层,后两者核外有3个电子层,电子层结构相同的离子,核电荷数越大的半径越小,所以,半径由小到大为⑤<④<⑦<⑥。
(4)①与⑦形成的某种化合物是四氯化碳,其经常用作萃取剂,其结构式为![]() ,该化合物属于共价化合物。④与③形成的淡黄色的固体是过氧化钠,其阴、阳离子分别是过氧根离子和钠离子,故阴、阳离子的个数比为1:2。
,该化合物属于共价化合物。④与③形成的淡黄色的固体是过氧化钠,其阴、阳离子分别是过氧根离子和钠离子,故阴、阳离子的个数比为1:2。
(5)氧元素与硫元素相比,能证明这两种元素非金属性强弱的事实有:氧的简单氢化物比硫的简单氢化物稳定;氧的单质能与硫的简单氢化物发生置换反应生成硫。常温下氧的单质和硫的单质状态不同、氧的简单氢化物的沸点比硫的简单氢化物的沸点高都与分子间作用力有关,与非金属性无关,所以,能证明这两种元素非金属性强弱的事实是BD。

【题目】某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3 . 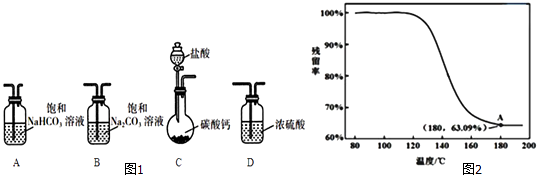
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 , 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 | 0.2molL﹣1 | 0.1molL﹣1 | 0.02molL﹣1 |
0.2molL﹣1 | 浑浊 | 浑浊 | 少许浑浊 |
0.1molL﹣1 | 浑浊 | 少许浑浊 | 无现象 |
0.02molL﹣1 | 少许浑浊 | 无现象 | 无现象 |
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l molL﹣1 NaHCO3溶液电离出的c(CO32﹣)为0.001lmolL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
答: .
(ii)产生浑浊(伴有气体产生)的离子方程式 .
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是 .
(残留率= ![]() ×100%)
×100%)
【题目】第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
(1)下列叙述正确的是 . (填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如表:
元素 | Mn | Fe | |
电离能 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn元素价电子排布式为 , 气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 .
(3)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 . 
(4)电镀厂排放的废水中常含有剧毒的CN﹣离子,可在X的催化下,先用NaClO将CN﹣氧化成CNO﹣ , 再在酸性条件下CNO﹣继续被NaClO氧化成N2和CO2 .
①与CNO﹣互为等电子体微粒的化学式为(写出一种即可).
②氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 .