题目内容
|
温度一定的条件下,在一个固定体积为 2 L的容器中,2 mol A气体和2 mol B气体发生反应:2A+B | |
| [ ] | |
A. |
大于 1.2 mol/L |
B. |
等于 1.2 mol/L |
C. |
等于 0.6 mol/L |
D. |
大于 0.6 mol/L |
答案:D
解析:
解析:
|
后 10 s中,反应物浓度比开始10 s的浓度要小,所以反应速率要小些,最终剩余的B要大于0.6 mol/L.计算时要注意题干中问的是浓度,不要误看成物质的量. |

练习册系列答案
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ?mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ?mol-1②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ?mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ?mol-1
下列说法正确的是( )
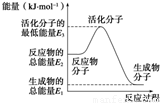
| A、反应②中的能量变化如图所示,则△H2=E1-E3 | B、H2的燃烧热为241.8 kJ?mol-1 | C、由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | D、氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ?mol-1 |
 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1