题目内容
【题目】某课外小组对金属钠进行了研究。已知C、D都是单质,F的水溶液是一种常见的强酸。
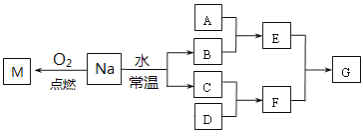
(1)F的名称是:______________
(2)金属Na在空气中放置足够长时间,最终的生成物是:________________
(3)该小组同学应该如何取用金属钠:_________________________________________
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出该过程的离子方程式:___________________

(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如右图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为__________________________。
(7)将NaHCO3与M的混合物在密闭容器中充分加热后排出气体,经测定,所得固体为纯净物,则NaHCO3与M的质量比为____________。
【答案】氯化氢 Na2CO3 用镊子从试剂瓶中取出一小块金属钠放在表面皿(或玻璃片)上,用滤纸吸干表面的煤油,用小刀切下一小块金属钠备用,剩余的金属钠放回原试剂瓶。 溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。 4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓ c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3 大于或等于168:78(或84:39)
【解析】
根据转化关系图可知:2Na+O2![]() Na2O2确定M为Na2O2;2Na+2H2O=2NaOH+H2↑,C、D都是单质,F的水溶液是一种常见的强酸,确定B为NaOH,C为H2,D为Cl2,F为HCl。
Na2O2确定M为Na2O2;2Na+2H2O=2NaOH+H2↑,C、D都是单质,F的水溶液是一种常见的强酸,确定B为NaOH,C为H2,D为Cl2,F为HCl。
(1)由上述分析可知,F为氯化氢;
答案:氯化氢。
(2)Na在空气中放置足够长时间,发生4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,则最终生成物为Na2CO3;
答案:Na2CO3。
(3)Na为活泼金属,保存在煤油中,取用方法为用镊子从试剂瓶中取出一小块金属钠放在表面皿(或玻璃片)上,用滤纸吸干表面的煤油,用小刀切下一小块金属钠备用,剩余的金属钠放回原试剂瓶,
答案:用镊子从试剂瓶中取出一小块金属钠放在表面皿(或玻璃片)上,用滤纸吸干表面的煤油,用小刀切下一小块金属钠备用,剩余的金属钠放回原试剂瓶。
(4)若A是一种常见金属单质,能与NaOH反应,则A为Al,E为NaAlO2,G为NaCl,将过量的F(HCl)溶液逐滴加入E(NaAlO2)溶液,边加边振荡,发生NaAlO2+HCl+H2O=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,所看到的实验现象是溶液中逐渐有白色絮状沉淀生成,且不断增加,然后又由多到少,最后消失;
答案:溶液中逐渐有白色絮状沉淀生成,且不断增加;然后又由多到少,最后消失。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A为可溶性亚铁盐,E为Fe(OH)3,则A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E这一过程的离子方程式为4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。
答案:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。
(6)A加入氢氧化钠溶液,分析图像可知:第一阶段是H++OH-=H2O,所以溶液呈酸性,不可能存在CO32-;第二阶段金属阳离子与氢氧根离子生成沉淀,第三阶段应该是NH4++OH-=NH3H2O;第四阶段氢氧化物沉淀与氢氧化钠反应最后全溶解,肯定没有Mg2+、Fe3+,必有Al3+。由此确定溶液中存在的离子H+、NH4+、Al3+、SO42-;假设图像中横坐标一个小格代表1molNaOH,则根据前三阶段化学方程式:H++OH-=H2O,Al3++3OH-=Al(OH)3,,NH4++OH-=NH3H2O,可知n(H+)=1mol,n(Al3+)=1mol,n(NH4+)=2mol,
再利用电荷守恒n(SO42-)×2=n(H+)×1+n(Al3+)×3+n(NH4+)×1,得出n(SO42-)=3mol,根据物质的量之比等于物质的量浓度之比得结论;
答案:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3
(7)将NaHCO3与M(过氧化钠)的混合物在密闭容器中充分加热发生的反应有三个:2NaHCO3![]() Na2CO3+CO2+H2O, 2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2,所得固体为纯净物,说明碳酸氢钠加热分解的二氧化碳必须把过氧化钠反应完,写出总的方程式
Na2CO3+CO2+H2O, 2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2,所得固体为纯净物,说明碳酸氢钠加热分解的二氧化碳必须把过氧化钠反应完,写出总的方程式
4NaHCO3+ 2Na2O2![]() 4Na2CO3+2H2O↑+O2↑
4Na2CO3+2H2O↑+O2↑
84×4g 78×2g
m(NaHCO3):m(Na2O2)=(84×4g):(78×2g)=168:78(或84:39),
碳酸氢钠可以过量,得到的还是纯净物,2NaHCO3![]() Na2CO3+CO2↑+H2O↑,
Na2CO3+CO2↑+H2O↑,
所以m(NaHCO3):m(Na2O2)≥168:78(或84:39);
答案:大于或等于168:78(或84:39)。