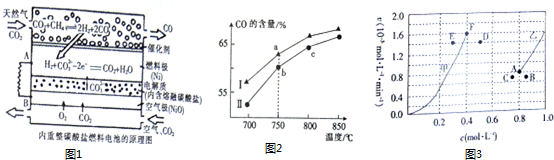
题目内容
11.电极反应的书写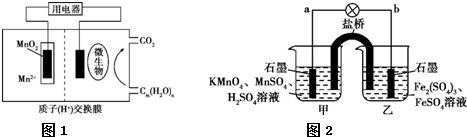
(1)常温下,燃烧1g乙烷(C2H6)气体的放出52kJ的热量,则乙烷燃烧的热化学方程式:2C2H6(g)+7O2 (g)=4CO2(g)+6H20(l);△H=-3120kJ/mol.以Pt作电极将乙烷设计为碱性燃料电池,在电极上分别通入乙烷和氧气.则负极反应式为C2H6-14e-+18OH-═2CO32-+12H2O.正极反应式为O2+2H2O+4e-=4OH-.当电路中通过0.7mol电子时提供46.8kJ的电能,则该燃料电池的能量转化效率为60%
(2)图1为一种微生物燃料电池结构示意图,若Cm(H2O)n为CH2O,则负极的电极反应式为CH2O-4e-+H2O=CO2+4H+.
(3)已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,Cl2+2FeCl2═2FeCl3.请结合以上信息分析图2中的原电池反应,甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O,乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+.
分析 (1)1g乙烷(C2H6)气体完全燃烧生成液态水放出热量52kJ,计算2mol乙烷完全燃烧放出热量=$\frac{\frac{52KJ×2mol}{1g}}{30g/mol}$=3120kJ,依据热化学方程式的书写标注物质聚集状态和对应焓变得到;
原电池中负极失电子,发生氧化反应;正极上得到电子,发生还原反应;分析电极反应,根据电子守恒结合总反应和正极反应计算得到负极电极反应;当电路中通过0.7mol电子时,消耗乙烷为0.05mol,若完全燃烧放出能量为$\frac{3120kJ/mol}{2}$×0.05mol=78kJ,然后计算该燃料电池的能量转化效率;
(2)CH2O在负极失电子被氧化生成二氧化碳和氢离子;
(3)甲烧杯中KMnO4得电子生成Mn2+,乙烧杯中亚铁离子得电子生成铁离子.
解答 解:(1)1g乙烷(C2H6)气体完全燃烧生成液态水放出热量52kJ,计算2mol乙烷完全燃烧放出热量=$\frac{\frac{52KJ×2mol}{1g}}{30g/mol}$=3120kJ,反应的热化学方程式为:
2C2H6(g)+7O2 (g)=4CO2(g)+6H20(l);△H=-3120kJ/mol;
利用反应①2 C2H6(g)+7 O2(g)→4 CO2(g)+6 H2O(l);设计原电池,根据化合价变化分析判断,乙烷失电子发生氧化反应,所以通入乙烷气体的电极应为负极,正极电极反应为:②O2+2H2O+4e-=4OH-; ①-②×7 得到负极电极反应为:C2H6-14e-+18OH-═2CO32-+12H2O;
当电路中通过0.7mol电子时,消耗乙烷为0.05mol,若完全燃烧放出能量为$\frac{3120kJ/mol}{2}$×0.05mol=78kJ,则该燃料电池的能量转化效率为$\frac{46.8}{78}$×100%=60%;
故答案为:2C2H6(g)+7O2 (g)=4CO2(g)+6H20(l);△H=-3120kJ/mol; C2H6-14e-+18OH-═2CO32-+12H2O;O2+2H2O+4e-=4OH-;60%;
(2)CH2O在负极失电子被氧化生成二氧化碳和氢离子,则负极的电极方程式为:CH2O-4e-+H2O=CO2+4H+;
故答案为:CH2O-4e-+H2O=CO2+4H+;
(3)甲烧杯中KMnO4得电子生成Mn2+,则甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O,乙烧杯中亚铁离子得电子生成铁离子,则乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+;
故答案为:MnO4-+5e-+8H+=Mn2++4H2O;5Fe2+-5e-=5Fe3+.
点评 本题考查了热化学方程式的书写方法和注意问题、反应焓变的计算、原电池原理的应用,题目难度中等,注意把握反应热的计算方法和电极方程式的书写,侧重于考查学生的分析能力和计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 所含分子数不相等 | B. | 所含原子数总数相等 | ||
| C. | 所含电子数相等 | D. | 所含氮原子数相等 |
| A. |  从煤焦油中提取苯 | B. |  实验室制乙酸乙酯 | ||
| C. | 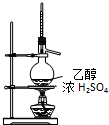 实验室制乙烯 | D. | 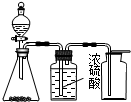 实验室制取、收集乙炔气体 |
| A. | 稀硫酸 | B. | 食盐水 | ||
| C. | 石灰水 | D. | 稀盐酸和澄清石灰水 |
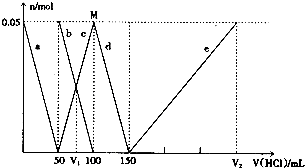
| A. | V1:V2=l:5 | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ |
 酚类
酚类 芳香烃
芳香烃  酯类
酯类 羧酸类
羧酸类