题目内容
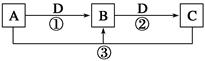
(10分)X、Y、Z三种元素常见单质在常温下都是气体,在适当条件下可发生如下图所示变化,X、Y、Z为三种短周期元素,它们的原子序数之和为16.
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
c.达到化学平衡时,Y的单质的体积分数仍为50%
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
(1)第二周期、VIA族(2分)
(2)氧气(2分)H2+2OH-=2H2O+2e-(2分)
(3)4NH3+5O2 4NO+6 H2O(2分)
4NO+6 H2O(2分)
(4)ac(2分)
解析试题分析:(1)常温下是无色气体的单质有H2、N2、O2,且三种元素的原子序数之和是16,氢气与氧气反应生成H2O,氢气与氮气反应生成NH3,氮气与氧气反应生成NO,根据一个B分子中含有的Z元素的原子个数比C分子中的少一个,判断B是H2O,C是NH3,Z元素是H。所以X是O元素,Y是N元素,A是NO。X在元素周期表中的位置是第二周期、VIA族;
(2)氧气与氢气形成的氢氧燃料电池中,正极发生还原反应,所以正极通入氧气,负极是氢气,氢气发生氧化反应,结合电解质溶液判断,负极的电极反应式为H2+2OH-=2H2O+2e-
(3)C是NH3,在高温、催化剂的条件下与氧气反应生成NO,化学方程式为4NH3+5O2 4NO+6 H2O;
4NO+6 H2O;
(4)氮气与氢气合成氨的反应是可逆反应,a、达到化学平衡时,正反应速率与逆反应速率相等,符合化学平衡的定义,正确;b、Y、Z以1:3的体积比转化,达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比一定不是1:1,错误;c、达到化学平衡时,等物质的量的Y、Z两种单质反应,设均为n则
N2+3H2 2NH3,
2NH3,
开始 n n 0
转化x 3x 2x
平衡n-x n-3x 2x
则Y单质的体积分数为(n-x)/(n-x+n-3x+2x)×100%=50%,正确;d、该反应是气体的物质的量减小的反应,质量不变时,混合气体的物质的量减小,则混合气体的平均相对分子质量增大,达到平衡时不再增大,错误,答案选a、c。
考点:考查元素的推断,电化学原理的应用,化学平衡的判断,化学方程式的书写

已知下列转化关系中M、N均为单质.则M不可能是
| A.Na | B.Cu | C.H2 | D.Cl2 |