题目内容
已知 (氯酸钾)在发生分解反应时会释放出
(氯酸钾)在发生分解反应时会释放出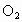 并生成KCl,但反应速率较低。
并生成KCl,但反应速率较低。
(1)你设想一下,有哪些条件可能提高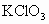 的分解反应速率?
的分解反应速率?
(2)写出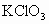 分解反应的化学方程式。
分解反应的化学方程式。
答案:略
解析:
解析:
|
思路分析: 影响化学反应速率的外界条件有温度、反应物浓度及催化剂,如果有气体参加反应,压强也会影响反应速率。本题的反应物为固体,所以主要影响因素有固体表面积,温度及催化剂。规范解答:(1)升高温度,将氯酸钾研细或使用催化剂都可以促进氯酸钾分解。 (2) |

练习册系列答案
相关题目
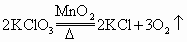
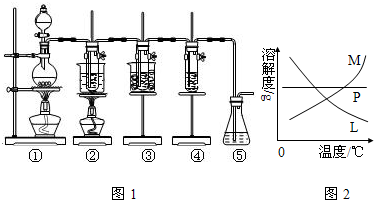
 某课外活动小组做了如下关于钾的探究实验.
某课外活动小组做了如下关于钾的探究实验.