题目内容
工业上用洗净的废铜片作原料制备硝酸铜,为了节约原料和防止污染环境,宜采用的方法是
- A.Cu+HNO3(浓)
- B.Cu+HNO3(稀)
- C.Cu+O2再加HNO3
- D.Cu+H2SO4(浓)再加Ba(NO3)2
C
分析:节约原料,则反应需步骤简单,消耗原料较少,为防止污染环境,应尽量少产生或不产生污染性气体.
A、根据方程式计算制备1molCu(NO3)2,需要HNO3的物质的量,生成NO2的物质的量.
B、根据方程式计算制备1molCu(NO3)2,需要HNO3的物质的量,生成NO的物质的量.
C、铜与氧气反应生成CuO,没有污染性气体生成,计算制备1molCu(NO3)2,需要HNO3的物质的量.
D、铜与浓硫酸反应生成污染性气体二氧化硫.
据此比较判断.
解答:A.浓硝酸与铜反应,制备1molCu(NO3)2,需要4molHNO3,中放出2molNO2气体NO2;
B.稀硝酸与铜反应生,制备1molCu(NO3)2,需要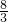 molHNO3,放出
molHNO3,放出  molNO气体;
molNO气体;
C.铜与氧气反应生成CuO,制备1molCu(NO3)2,需要2molHNO3,且没有生成污染性气体;
D.铜与浓硫酸反应生成污染性气体二氧化硫.
由上述分析可知,C选项中方案,消耗原料少,且基本无污染.
故选:C.
点评:考查学生对实验方案的理解与评价、环境保护等,难度不大,实质是根据方程式的计算.注意基础知识的灵活运用与掌握.
分析:节约原料,则反应需步骤简单,消耗原料较少,为防止污染环境,应尽量少产生或不产生污染性气体.
A、根据方程式计算制备1molCu(NO3)2,需要HNO3的物质的量,生成NO2的物质的量.
B、根据方程式计算制备1molCu(NO3)2,需要HNO3的物质的量,生成NO的物质的量.
C、铜与氧气反应生成CuO,没有污染性气体生成,计算制备1molCu(NO3)2,需要HNO3的物质的量.
D、铜与浓硫酸反应生成污染性气体二氧化硫.
据此比较判断.
解答:A.浓硝酸与铜反应,制备1molCu(NO3)2,需要4molHNO3,中放出2molNO2气体NO2;
B.稀硝酸与铜反应生,制备1molCu(NO3)2,需要
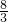 molHNO3,放出
molHNO3,放出  molNO气体;
molNO气体;C.铜与氧气反应生成CuO,制备1molCu(NO3)2,需要2molHNO3,且没有生成污染性气体;
D.铜与浓硫酸反应生成污染性气体二氧化硫.
由上述分析可知,C选项中方案,消耗原料少,且基本无污染.
故选:C.
点评:考查学生对实验方案的理解与评价、环境保护等,难度不大,实质是根据方程式的计算.注意基础知识的灵活运用与掌握.

练习册系列答案
相关题目
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① |  | FeCl2 | FeC13 | Fe | CuCl2 |
| ② | NO | NO2 | N2 | HNO3 | |
| ③ | Na2O | Na2O2 | Na | NaOH | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
- A.①④
- B.①②③
- C.①③④
- D.②④