题目内容
6.下列元素中,属于第二周期且原子半径较大的是( )| A. | N | B. | F | C. | Na | D. | Al |
分析 电子层越多,原子半径越大,同周期从左向右原子半径减小,以此来解答.
解答 解:Na、Al位于第三周期,N、F位于第二周期,同周期从左向右原子半径减小,则属于第二周期且原子半径较大的是N,
故选A.
点评 本题考查原子半径的比较,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
17.山梨酸是一种食品添加剂的成分,其结构如图所示,下列说法正确的是( )
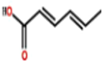

| A. | 该有机物与等物质的量Br2发生加成反应时,可生成两种加成产物 | |
| B. | 该有机物能与金属Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液发生反应 | |
| C. | 该有机物能发生加成、取代、氧化、消去、加聚反应 | |
| D. | 可使用酸性高锰酸钾溶液鉴别该有机物和乳酸(2-羟基丙酸) |
14.结构与物质稳定性有关, 发生消去反应,依据能量观念判断所生成的物质最有可能的是( )
发生消去反应,依据能量观念判断所生成的物质最有可能的是( )

 发生消去反应,依据能量观念判断所生成的物质最有可能的是( )
发生消去反应,依据能量观念判断所生成的物质最有可能的是( )
| A. | 甲物质 | B. | 乙物质 | C. | 丙物质 | D. | 丁物质 |
1.一定条件下,温度对有机污染物P-CP降解反应的影响如图所示.下列判断不正确的是( )
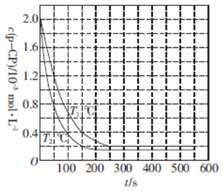

| A. | T1<T2 | |
| B. | p-CP降解反应是吸热反应 | |
| C. | 其他条件相同时,温度越高,反应速率越快 | |
| D. | T1℃时,在50〜150 s之间p-CP的平均降解速率为1.6×10-5 mol•L-1•s-1 |
11.锌与过量的稀盐酸反应,为了加快反应速率,又不影响生成氢气的总量,可以采取的措施是( )
| A. | 加入浓盐酸 | B. | 加入一定量CuSO4固体 | ||
| C. | 加入适量的水 | D. | 降低温度 |
18.下列各组粒子互为等电子体,且中心原子均进行sp3杂化的是( )
| A. | N3-与CO2 | B. | BF3和C O32- | C. | NO2+与CO2 | D. | H3O+与NH3 |
5.下列分离和提纯的实验操作中,正确的是( )
| A. |  蒸发 | B. |  过滤 | ||
| C. |  蒸馏 | D. |  分液 |
