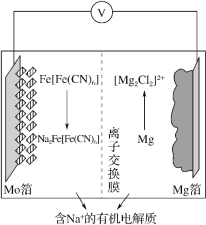
��Ŀ����
����Ŀ��ijУѧϰС���ͬѧ���ù�ҵ����м(��Ҫ�ɷ�ΪFe������������FeS��)�Ʊ�FeSO4��7H2O�����ⶨFeSO4��7H2O�Ĵ��ȡ�
I���Ʊ�ʵ�鲽��������
�ٳ�ȡһ�����ķ���м�����ȵ�̼������Һ���ݣ���������ˮϴ�ӡ�
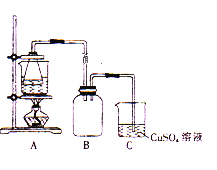
�ڽ�������ķ���м������ƿ������������3mol/L�����������Ӻ�װ��(��ͼ)��ˮԡ��������Ӧ��ȫ��
����������ֹͣ���ȣ����ȹ��ˣ�����Һ�в����������ᡣ
�ܽ���Һ��ȴ���ᾧ�����ˡ�ϴ�ӡ�
�ش���������
��1����������ȵ�̼������Һ���ݵ�Ŀ����____ ��
��2�������������������������ʹ���۹�������Ŀ����_____________��
��3��װ��C��������_____________�������йط�Ӧ�����ӷ���ʽΪ_____________��
��4���������ϴ��ʱ���õ�ϴ�Ӽ������_____________��
A��ϡ���� B����ˮ�Ҵ� C����
II���ⶨ��Ʒ�Ĵ�����
��ȡm g��Ʒ��������ƿ�У��þ���й�����ȴ������ˮ��ϡ�����ܽ���Ȼ����c mol/L��KMnO4����Һ�ζ�������VmL KMnO4����Һ���ζ�������ѡ��___��������ʽ��������ʽ�����ζ��ܣ�������Ӧ�����ӷ���ʽΪ________����Ʒ�Ĵ���Ϊ_________(�г��������ʽ����)��
���𰸡���ȥ����м��������� ��֤��Һ�в���Fe3+ ��ȥH2S H2S+Cu2+ ��CuS��+2H+ B ��ʽ MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O ![]() ��
��
��������
��1����������ȵ�̼������Һ���ݵ�Ŀ���dz�ȥ����м��������ۡ�
��2��Fe2���ױ������е���������ΪFe3���������������������������ʹ���۹�������Ŀ���DZ�֤��Һ�в���Fe3+ ��
��3������м��FeS��ϡ���ᷴӦ�����ж���H2S��Cװ����ʢװ������ͭ��Һ�����ж���H2S���壬��ֹ��Ⱦ�����������йط�Ӧ�����ӷ���ʽΪH2S+Cu2����CuS��+2H����
��4����FeSO4��7H2O������ˮ���������ϴ��ʱ���õ�ϴ�Ӽ��������ˮ�Ҵ�����ѡB��
II��KMnO4����Һ����ǿ�����ԣ��ζ�������ѡ����ʽ�ζ��ܣ���KMnO4����Һ�ζ�FeSO4��Һ����Һ��Fe2������ΪFe3������ԭ����ΪMn2����������Ӧ�����ӷ���ʽΪMnO4��+5Fe2��+8H��=Mn2��+5Fe3��+4H2O��
�ζ�ʱ����VmLcmol��L��1KMnO4����Һ��KMnO4�����ʵ���ΪVc��10-3mol����FeSO4�����ʵ���Ϊ5Vc��10-3mol����Ʒ�Ĵ���Ϊ5Vc��10-3mol��278g��mol��1/m��100%=![]() ����
����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���о���ͬ pH ʱ CuSO4 ��Һ�� H2O2 �ֽ�Ĵ����á����ϣ�a��Cu2O Ϊ��ɫ���壬������ˮ�����������ᣬ���� Cu ��Cu2+��b��CuO2 Ϊ�غ�ɫ���壬������ˮ�����������ᣬ���� Cu2+�� H2O2��c��H2O2 �������ԣ�H2O2 ![]() H+ +HO2-��HO2-
H+ +HO2-��HO2- ![]() H+ +O22-��
H+ +O22-��
��� | ʵ�� | ���� |
�� | �� 1 mL pH��2 �� 1 mol��L 1 CuSO4��Һ�м��� 0.5 mL 30% H2O2 ��Һ | ������������ |
�� | �� 1 mL pH��3 �� 1 mol��L 1 CuSO4��Һ�м��� 0.5 mL 30% H2O2 ��Һ | �������������ػ�ɫ���������ֽ��������� |
�� | �� 1 mL pH��5 �� 1 mol��L 1CuSO4��Һ�м��� 0.5 mL 30% H2O2 ��Һ | �������������غ�ɫ������������������ |
��1�� ���������ɵ������Ϊ O2������ CuSO4 ���ֽ� H2O2 �Ļ�ѧ����ʽ��__��
��2���Ԣ����غ�ɫ�����ijɷ���� 2 �ּ��裺��.CuO2����.Cu2O ��CuO2 �Ļ���Ϊ�����������裬����ʵ��������ˢ��еij�����ϴ�ӣ�����������ᣬ������ȫ�ܽ⣬��Һ����ɫ���������������ݡ�
�����������ɵij���Ϊ CuO2���䷴Ӧ�����ӷ���ʽ��__��
�����ݢ��г�����ȫ�ܽ⣬��ͬѧ��Ϊ���袢����������ͬѧ��ͬ���ͬѧ�Ĺ۵㣬������__��
��Ϊ̽���������Ƿ���� Cu2O���������ʵ�飺
�����г���ϴ�ӡ������ȡ a g �������ڹ���ϡ���ᣬ��ּ��ȡ���ȴ�������Һ pH���� PAN Ϊָʾ��������Һ�еμ� c mol��L 1EDTA ��Һ���ζ��յ㣬���� EDTA ��Һ V mL��V=__����֪�����в��� Cu2O�����袡����������֪��Cu2++EDTA= EDTA-Cu2+��M(CuO2)��96 g��mol 1��M(Cu2O)��144 g��mol1��
��3����Ϸ���ʽ�����û�ѧ��Ӧԭ�����͢������ɵij������ڢ��е�ԭ��__ ��
��4���о����в�ͬ pH ʱ H2O2 �ֽ����ʲ�ͬ��ԭ��
ʵ��������Թ��зֱ�ȡ 1 mL pH��2��3��5 �� 1 mol��L1 Na2SO4 ��Һ�������и����� 0.5 mL 30% H2O2 ��Һ����֧�Թ��о�����������
ʵ�����__����ʵ�����������˵�� CuO2 �ܹ��� H2O2 �ֽ⡣
��5���ۺ�����ʵ�飬���в�ͬ pH ʱ H2O2 �ķֽ����ʲ�ͬ��ԭ����__��