题目内容
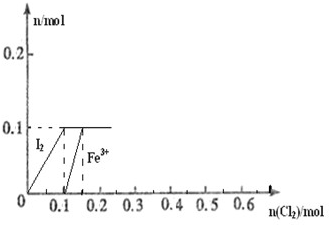
 向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的
顺序为
I-
I-
>Fe2+
Fe2+
>I2
I2
.(2)当n(Cl2)=0.12mol时,溶液中的离子主要为
Fe2+、Fe3+、Cl-
Fe2+、Fe3+、Cl-
,从开始通入Cl2到n(Cl2)=0.12mol时的总反应的化学方程式为5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2
5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2
.(3)当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为
8.96L
8.96L
.分析:(1)在氧化还原反应中还原性越强的微粒越溶液失电子,根据生成I2、Fe3+、IO3-的先后顺序确定I-、Fe2+、I2三种粒子的还原性强弱;
(2)先根据图象结合Cl2+FeI2=FeCl2+I2 计算碘化亚铁的物质的量,再结合离子还原性的先后顺序确定生成物,从而确定溶液中的离子;
(3)溶液中含有碘酸根离子说明亚铁离子完全转化为铁离子,碘离子先转化为碘单质,碘单质再转化为碘酸根离子,根据氧化还原反应中得失电子数相等计算氯气的体积.
(2)先根据图象结合Cl2+FeI2=FeCl2+I2 计算碘化亚铁的物质的量,再结合离子还原性的先后顺序确定生成物,从而确定溶液中的离子;
(3)溶液中含有碘酸根离子说明亚铁离子完全转化为铁离子,碘离子先转化为碘单质,碘单质再转化为碘酸根离子,根据氧化还原反应中得失电子数相等计算氯气的体积.
解答:解:(1)向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,在氧化还原反应中还原性越强的微粒越溶液失电子,由此说明I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为I-、Fe2+、I2,故答案为:I-;Fe2+;I2;
(2)根据图象,结合反应Cl2+FeI2=FeCl2+I2 知,当通入0.1molCl2时碘离子完全被氧化生成碘单质,碘化亚铁的物质的量是0.1mol;向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,所以当通入Cl2到n(Cl2)=0.12mol时,氯气和亚铁离子反应生成铁离子,2Fe2++Cl2=2Fe3++2Cl-,通入氯气的物质的量是0.02mol时,有0.04mol亚铁离子被氧化,还剩0.06mol亚铁离子,所以溶液中存在的离子是Fe2+、Fe3+、Cl-,发生的离子反应方程式为5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2,
故答案为:Fe2+、Fe3+、Cl-;5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2;
(3)但碘离子转化为碘酸根离子时,亚铁离子完全转化为铁离子,设碘酸根的物质的量是x,则氯离子的物质的量是8x,根据氧化还原反应中得失电子数相等得x×6+(0.2-x)×1+0.1×1=8x×1,x=0.1,所以溶液中碘酸根的物质的量是0.1mol,氯离子的物质的量是0.8mol,根据Cl2~2Cl-知,氯气的物质的量是0.4mol,氯气的体积=0.4mol×22.4L/mol=8.96L,
故答案为:8.96L.
(2)根据图象,结合反应Cl2+FeI2=FeCl2+I2 知,当通入0.1molCl2时碘离子完全被氧化生成碘单质,碘化亚铁的物质的量是0.1mol;向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,所以当通入Cl2到n(Cl2)=0.12mol时,氯气和亚铁离子反应生成铁离子,2Fe2++Cl2=2Fe3++2Cl-,通入氯气的物质的量是0.02mol时,有0.04mol亚铁离子被氧化,还剩0.06mol亚铁离子,所以溶液中存在的离子是Fe2+、Fe3+、Cl-,发生的离子反应方程式为5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2,
故答案为:Fe2+、Fe3+、Cl-;5FeI2+6Cl2=5I2↓+2FeCl3+3FeCl2;
(3)但碘离子转化为碘酸根离子时,亚铁离子完全转化为铁离子,设碘酸根的物质的量是x,则氯离子的物质的量是8x,根据氧化还原反应中得失电子数相等得x×6+(0.2-x)×1+0.1×1=8x×1,x=0.1,所以溶液中碘酸根的物质的量是0.1mol,氯离子的物质的量是0.8mol,根据Cl2~2Cl-知,氯气的物质的量是0.4mol,氯气的体积=0.4mol×22.4L/mol=8.96L,
故答案为:8.96L.
点评:本题考查了氧化还原反应的有关知识,明确离子反应的先后顺序是解本题的关键,根据得失电子数相等结合离子反应的先后顺序即可分析解答(3)题,难度较大.

练习册系列答案
相关题目
 向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
向100mL FeI2溶液中逐渐通入Cl2,会依次生成Cl-、I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
 1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的
1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的