题目内容
16.下列关于常温下,pH=3的醋酸溶液(I)和 pH=11的氢氧化钠溶液(Ⅱ)的说法正确的是( )| A. | I和Ⅱ的物质的量浓度均为0.001mol•L-1 | |
| B. | 将I稀释10倍,溶液中 c(CH3COOH)、c(OHˉ)均减小 | |
| C. | I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量 | |
| D. | I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH--) |
分析 醋酸是一元酸、NaOH是一元碱,常温下,pH=3的醋酸溶液中c(H+)等于pH=11的NaOH溶液中c(OH-),醋酸是弱电解质、NaOH是强电解质,所以醋酸浓度远远大于NaOH.
解答 解:A、Ⅱ的物质的量浓度是0.001mol•L-1,Ⅰ的物质的量浓度大于0.001mol•L-1,故A错误;
B、醋酸稀释,酸性减弱,氢氧根离子浓度增大,故B错误;
C、醋酸与氢氧化钠恰好中和时,溶液显碱性,所以若c(OH-)>c(H+),氢氧化钠不一定过量,故C错误;
D、I和Ⅱ等体积混合后,醋酸物质的量远远大于氢氧化钠,混合溶液显酸性,据电荷守恒可知,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查探究溶液酸碱性,为高考高频点,明确溶液中的溶质及其性质是解本题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.加入洗洁精的水能洗去餐具上的油污,利用的原理是( )
| A. | 油污溶解在水中 | B. | 油污与水发生化学反应 | ||
| C. | 洗洁精使油污发生乳化 | D. | 洗洁精增大了油污的溶解度 |
7.甲烷的燃烧热890.3kJ•mol-1,1kg CH4在25℃,101kPa时充分燃烧生成液态水放出的热量约为( )
| A. | -5.56×104 kJ•mol1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
4.化学与生产、生活密切相关.下列有关叙述正确的是( )
| A. | 泡沫灭火器中用的是苏打和硫酸铝 | |
| B. | 通过干馏可将煤中含有的苯、甲苯等物质分离出来 | |
| C. | 地沟油通过水解反应可得到车用汽油 | |
| D. | 家庭用洁厕灵与“84消毒液”不能同时使用 |
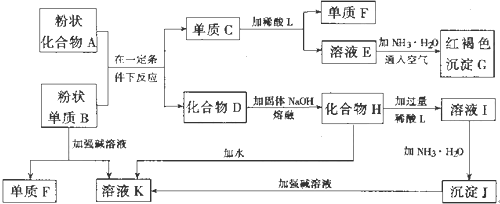
11. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
请回答下列问题.
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
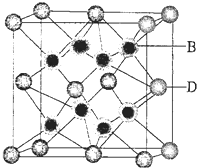
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A元素的一种原子没有中子,只有一个质子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成砖红色(红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时M层的电子排布式3s23p63d10
(2)C元素单质分子中含有δ和π键的键数之比为1:2.
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:甲醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小:C2A4分子中C原子轨道的杂化类型是sp3.
(4)A、C、E三种元素可形成:E(CA3)42+配离子,其中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(CA3)42+具有对称的空间构型.且当 E(CA3)42+中的两个CA3分子被两个Cl取代时.能得到两种不同结构的产物,则 E(CA3)42+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物.其晶胞结构如图所示.其中D离子的配位数为8.若该晶体的密度为a g•cm-3,则该晶胞中距离最近的B和D之间的距离是$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{78×4}{ρ{N}_{A}}}$cm(写出表达式即可,NA代表阿伏加得罗常数)
1.A、B、C、D、E五种短周期元素的原子序数依次增大,A和D、C和E分别同主族,E的原子序数为C的两倍,B的最外层电子数为A的最外层电子数的4倍.下列叙述正确的是( )
| A. | A、B、C三种元素形成的化合物一定是非电解质 | |
| B. | A与C只能形成化学式为A2C的化合物 | |
| C. | 第三周期中,D的原子半径最大 | |
| D. | E的氧化物对应的水化物一定具有强氧化性 |
5.下表为元素周期表的一部分,参照元素①~⑨在表中的位置,按要求回答下列问题:
(1)在标号元素中,最活泼的金属元素名称是钠最活泼的非金属元素名称是氟.
⑨元素的原子结构简示意图 .
.
(2)用电子式表示 ①与②形成共价化合物的形成过程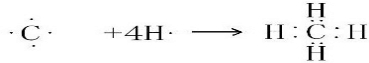 .
.
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是⑤>⑥>⑦(序号表示).
(4)①~⑨元素所形成的气态氢化物中,最稳定的是HF(化学式表示)
⑦、⑧、⑨三种元素的气态氢化物的稳定由强到弱的顺序HCl>PH3>SiH4(化学式表示).
(5)写出元素⑨的单质与溴化钠反应的离子方程式:2Br-+Cl2=2Cl-+Br2.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
⑨元素的原子结构简示意图
 .
.(2)用电子式表示 ①与②形成共价化合物的形成过程
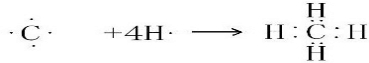 .
.(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是⑤>⑥>⑦(序号表示).
(4)①~⑨元素所形成的气态氢化物中,最稳定的是HF(化学式表示)
⑦、⑧、⑨三种元素的气态氢化物的稳定由强到弱的顺序HCl>PH3>SiH4(化学式表示).
(5)写出元素⑨的单质与溴化钠反应的离子方程式:2Br-+Cl2=2Cl-+Br2.
6.下列说法不正确的是( )
| A. | 油脂能发生皂化反应 | B. | 蛋白质水解的最终产物是氨基酸 | ||
| C. | 纤维素不能发生水解反应 | D. | 淀粉完全水解的产物是葡萄糖 |