题目内容
6.实验中需用2.0mol/L的Na2CO3溶液950ml,配制时应选用的容量瓶的规格和称取的质量分别为( )| A. | 950ml;201.4g | B. | 1000ml; 212g | C. | 100ml; 21.2g | D. | 500ml; 100.7g |
分析 由于容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,然后根据m=cVM进行计算.
解答 解:容量瓶没有950mL规格,应用1000mL的容量瓶进行配制,则m(Na2CO3)=cVM=1L×2mol/L×106g/mol=212g,
故选B.
点评 本题考查溶液的配制知识,题目难度不大,注意实验室常用容量瓶的规格.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol NaHSO4晶体中离子总数为3NA | |
| B. | 2.24L14CH4分子中所含中子数为0.8NA | |
| C. | 0.1L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3 NA | |
| D. | 标况下,将FeSO4溶液置于空气中,被氧化的Fe2+为0.2 NA,吸收O2为1.12 L |
17.某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式沉淀时的pH如表:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外,还需要的主要仪器有漏斗、蒸发皿.
(2)“碱浸”过程中发生反应的离子方程式有Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).

部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式有Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O、2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)“酸浸”时所加入的酸是H2SO4(填化学式).
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
14.在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态的是 ( )
| A. | C的物质的量浓度 | B. | 混合气体的密度 | ||
| C. | 容器内压强 | D. | 混合气体的平均分子量 |
1.在前一种分散系中慢慢地滴入后一种溶液所观察到的现象不是先沉淀后变澄清的是( )
| A. | 氢氧化铁胶体滴加盐酸 | B. | 四羟基合铝酸钠溶液中加盐酸 | ||
| C. | 氯化铝溶液中滴加氢氧化钠溶液 | D. | 氯化铝溶液中滴加氨水 |
16.下列离子方程式的书写正确的是( )
| A. | 铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| C. | 氯化铝溶液与足量氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
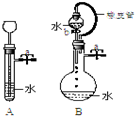 根据如图描述回答下列问题:
根据如图描述回答下列问题:
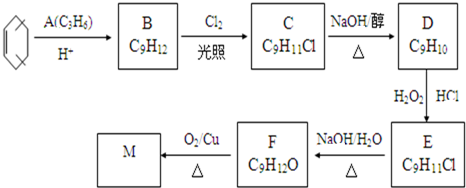
 ;
; ;
;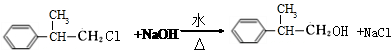 .
.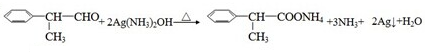 .
.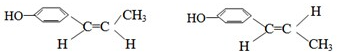 .
.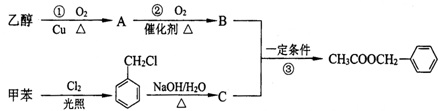
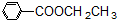 、
、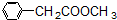 、
、
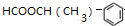 和
和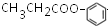 .
.