题目内容
(1)下表是四种同主族元素的氧化物的离子晶体晶格能数据.
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/kJ?mol-1 | 3791 | 3410 | 3223 | 3054 |
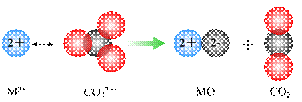
②碳酸盐的热分解示意图如图1.两种碳酸盐的热分解温度CaCO3

(2)已知NH3?H2O的电离方程式为NH3?H2O?NH4++OH-,当氨水冷却时,可以将NH3?H2O和2NH3?H2O等晶体沉淀出来.
①2NH3?H2O的晶体类型为
②NH3极易溶于水,其主要原因是
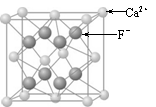
(3)CaF2的晶体结构如图2所示.
①CaF2晶体中钙离子的配位数是
②一个CaF2晶胞中包含
②离子键越弱,对应晶格能越小,越易分解;
(2)①NH3?H2O在晶体中以分子的形式存在;
②NH3能与水分子形成氢键;
(3)①CaF2晶体中与钙离子距离最近的氟离子有8个;
②根据晶胞中微粒数目求算方法.
②Ca2+、Sr2+为同主族元素的离子,从上到下,离子半径逐渐增大,离子键越弱,对应氧化物的晶格能越小,所以SrCO3比CaCO3易分解,故答案为:高于;
(2)①NH3?H2O在晶体中以分子的形式存在,属于分子晶体,故答案为:分子晶体;
②NH3极易溶于水,是因为NH3能与水分子形成氢键,故答案为:NH3与H2O形成分子间氢键;
(3)①CaF2晶体中与钙离子距离最近的氟离子有8个,所以其配位数为8,故答案为:8;
②根据晶胞中微粒数目求算方法,钙离子位于晶胞的8个顶点和6个面上,
| 1 |
| 8 |
| 1 |
| 6 |

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案(12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/ kJ·mol-1 | 3791 | 3410 | 3223 | 3054 |
①将上表中四种氧化物的共熔物冷却,首先析出的是 ▲ 。
②碳酸盐的热分解示意图如下图。两种碳酸盐的热分解温度CaCO3 ▲ SrCO3(填“高于”或“低于”)

⑵已知NH3·H2O的电离方程式为NH3·H2ONH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
①2NH3·H2O的晶体类型为 ▲ 。
②NH3极易溶于水,其主要原因是 ▲ 。
⑶CaF2的晶体结构如图所示。
①CaF2晶体中钙离子的配位数是 ▲ 。
②一个CaF2晶胞中包含 ▲ 个钙离子。
(12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
|
氧化物 |
MgO |
CaO |
SrO |
BaO |
|
晶格能/ kJ·mol-1 |
3791 |
3410 |
3223 |
3054 |
①将上表中四种氧化物的共熔物冷却,首先析出的是 ▲ 。
②碳酸盐的热分解示意图如下图。两种碳酸盐的热分解温度CaCO3 ▲ SrCO3(填“高于”或“低于”)

⑵已知NH3·H2O的电离方程式为NH3·H2O NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
①2NH3·H2O的晶体类型为 ▲ 。
②NH3极易溶于水,其主要原因是 ▲ 。
⑶CaF2的晶体结构如图所示。

①CaF2晶体中钙离子的配位数是 ▲ 。
②一个CaF2晶胞中包含 ▲ 个钙离子。
(12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/ kJ·mol-1 | 3791 | 3410 | 3223 | 3054 |
①将上表中四种氧化物的共熔物冷却,首先析出的是 ▲ 。
②碳酸盐的热分解示意图如下图。两种碳酸盐的热分解温度CaCO3 ▲ SrCO3(填“高于”或“低于”)
 ⑵已知NH3·H2O的电离方程式为NH3·H2O
⑵已知NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
①2NH3·H2O的晶体类型为 ▲ 。
②NH3极易溶于水,其主要原因是 ▲ 。
⑶CaF2的晶体结构如右图所示。
①CaF2晶体中钙离子的配位数是 ▲ 。
②一个CaF2晶胞中包含 ▲ 个钙离子。

 NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。