题目内容
写出下列物质的电子式:
NaOH N2 Na2O2 CO2 .
NaOH
考点:电子式
专题:化学用语专题
分析:氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
氮气中存在3对共用电子对,氮原子最外层达到8个电子;
过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子.
氮气中存在3对共用电子对,氮原子最外层达到8个电子;
过氧化钠中两个钠离子与过氧根离子通过离子键结合,两个氧原子通过共用1对电子结合;
二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子.
解答:
解:氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ;
;
氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ;
;
Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ;
;
二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: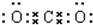 ,
,
故答案为: ;
; ;
; ;
;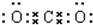 .
.
 ;
;氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为
 ;
;Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为
 ;
;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:
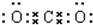 ,
,故答案为:
 ;
; ;
; ;
;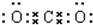 .
.
点评:本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及正确的表示方法,明确离子化合物中阴离子需要标出最外层电子,阳离子直接用离子符号表示.

练习册系列答案
相关题目
 X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示.下列分析不正确的是( )
X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体的晶胞结构如图所示.下列分析不正确的是( )| A、X+离子为K+ |
| B、该晶体中白色球代表N3- |
| C、阴阳离子的半径比是决定离子晶体结构的重要因素 |
| D、N3-填入X+构成的正八面体空隙 |
 某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.

