题目内容
【题目】根据所学知识完成下面题目:
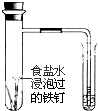
(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3 , 而在盐酸中生成浅绿色的FeCl2溶液.则在Cl2、Cl﹣、H+中,具有氧化性的是 , 其中氧化性强的是 .
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性.现有如下三个反应,请写出盐酸在三个反应中,分别表现什么性质:①NaOH+HCl═NaCl+H2O;
②2HCl ![]() H2↑+Cl2↑ .
H2↑+Cl2↑ .
③MnO2+4HCl(浓 ![]() MnCl2+Cl2↑+2H2O .
MnCl2+Cl2↑+2H2O .
(3)并用“双线桥法”标出反应③电子转移的方向和数目 .
(4)在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,写出反应的化学方程式(不必配平) .
【答案】
(1)Cl2、H+;Cl2
(2)酸性;既表现氧化性又表现还原性;酸性和还原性
(3)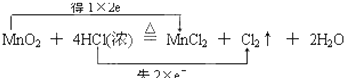
(4)2FeCl3+H2S═2FeCl2+S↓+2HCl
【解析】解:(1)在Cl2、Cl﹣、H+中氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+ , 其中氧化性最强的是Cl2 , 所以答案是:Cl2、H+;Cl2;(2)①NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;所以答案是:酸性;②2HCl ![]() H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高,所以HCl既表现氧化性又表现还原性,所以答案是:既表现氧化性又表现还原性;③反应MnO2+4HCl(浓
H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高,所以HCl既表现氧化性又表现还原性,所以答案是:既表现氧化性又表现还原性;③反应MnO2+4HCl(浓 ![]() MnCl2+Cl2↑+2H2O中,Cl元素的化合价升高,盐酸表现还原性,且生成氯化锰,盐酸表现酸性,所以答案是:酸性和还原性;(3)Mn元素的化合价从+4价降为+2价,Cl元素从﹣1价升高为0价,可通过双线桥分析此氧化还原反应,
MnCl2+Cl2↑+2H2O中,Cl元素的化合价升高,盐酸表现还原性,且生成氯化锰,盐酸表现酸性,所以答案是:酸性和还原性;(3)Mn元素的化合价从+4价降为+2价,Cl元素从﹣1价升高为0价,可通过双线桥分析此氧化还原反应, 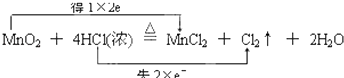 ,所以答案是:
,所以答案是: 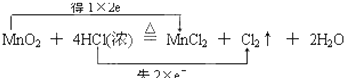 ;(4)已知H2S为反应物,则反应为H2S→S,则另一反应物应具有氧化性,应为FeCl3 , 则发生反应为2FeCl3+H2S═2FeCl2+S↓+2HCl,所以答案是:2FeCl3+H2S═2FeCl2+S↓+2HCl.
;(4)已知H2S为反应物,则反应为H2S→S,则另一反应物应具有氧化性,应为FeCl3 , 则发生反应为2FeCl3+H2S═2FeCl2+S↓+2HCl,所以答案是:2FeCl3+H2S═2FeCl2+S↓+2HCl.

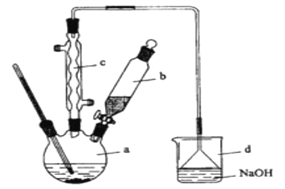
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体。继续滴加至液溴滴完。装置d的作用是_____________;制取溴苯的化学方程式___________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是:____________________。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是___;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是_______(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:; 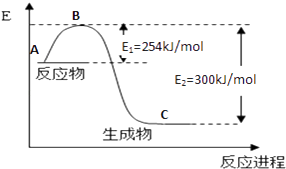
(2)若已知下列数据:
化学键 | H﹣H | N≡N |
键能/kJmol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能kJmol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 , E2(填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如 4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2 , 则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示)