题目内容
6.在下列氧化还原反应中,水只作还原剂的是( )| A. | Mg+2H2O═Mg(OH)2+H2↑ | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2F2+2H2O═O2+4HF | D. | 3NO2+H2O═2HNO3+NO |
分析 H2O中H元素的化合价为+1价,O元素的化合价为-2价,如水只作还原剂,则反应中O元素化合价升高,被氧化,以此解答.
解答 解:A.H元素化合价降低,被还原,水为氧化剂,故A错误;
B.H元素化合价降低,O元素化合价升高,水既是氧化剂也是还原剂,故B错误;
C.O元素化合价升高,被氧化,水为还原剂,故C正确;
D.只有N元素化合价发生变化,水既不是氧化剂也不是还原剂,故D错误.
故选C.
点评 本题考查氧化还原反应及氧化还原反应中水的作用,明确元素的化合价变化是解答的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氯化钠溶液中滴入硝酸银溶液 | B. | 金属钠在氯气中燃烧生成氯化钠 | ||
| C. | 铁片置于硫酸铜溶液中 | D. | 氢氧化钠溶液与稀硫酸反应 |
17.下列方程式书写正确的是( )
| A. | 101kPa时,能表示H2燃烧热的热化学方程式为:H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol | |
| B. | 向Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,沉淀溶解,其离子方程式为:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 电解精炼铜的阳极反应式为:Cu2++2e-=Cu | |
| D. | 硫代硫酸钠溶液中加入稀硫酸变浑浊:S2O32-+2H+=S↓+SO2↑+H2O |
14.下列说法正确的是( )
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 非极性共价键只能存在于非金属单质中,不可能存在于化合物中 | |
| C. | 含有离子键的化合物一定是离子化合物,在离子化合物中可以含有非极性共价键 | |
| D. | 凡是能电离出离子的化合物都是离子化合物 |
1.下列物质中,属于烷烃的是( )
| A. | 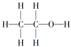 | B. | 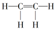 | C. |  | D. | 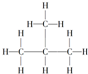 |
11.从化学学科的角度分析,下列叙述不正确的是( )
| A. | 绿色植物光合作用过程中是由太阳能转变成化学能 | |
| B. | 研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放 | |
| C. | 煤、石油、天然气属于可再生能源 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
18.下列分子中,含有两个π键的是( )
①H-C≡N ②H2O ③N2 ④H2O2⑤C2H4 ⑥C2H2.
①H-C≡N ②H2O ③N2 ④H2O2⑤C2H4 ⑥C2H2.
| A. | ①③⑥ | B. | ③④⑤⑥ | C. | ①②③⑥ | D. | ③⑤⑥ |
15.下列有机物的结构表示不正确的是( )
| A. | CH4的球棍模型示意图为 | B. | 丁烯的键线式为 | ||
| C. | 乙醇的结构式为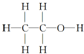 | D. | 乙酸的最简式为CH2O |
16.下列反应得到的产物一定是纯净物的是( )
| A. | Mg在空气中燃烧 | B. | 铁丝在氯气中燃烧 | ||
| C. | 足量铜与浓硝酸充分反应 | D. | 足量锌粒与浓硫酸反应得到的气体 |