题目内容
4.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:Cu+2AgNO3═Cu(NO3)2+2Ag.(1)画出装置图;
(2)标出电极材料和电解质溶液及电子流向;
(3)写出电极反应式.
分析 (1)根据反应Cu+2AgNO3═Cu(NO3)2+2Ag,Cu失电子发生氧化反应为负极,正极为AgNO3得电子发生还原反应,据此判断正负极及电解质溶液;
(2)电子流向为负极流向正极;
(3)负极失电子发生氧化反应,正极为AgNO3得电子发生还原反应,据此书写电极反应式.
解答 解:(1)根据Cu+2AgNO3═Cu(NO3)2+2Ag反应方程式知,Cu失电子发生氧化反应为负极,正极为AgNO3得电子发生还原反应,所以选铜、银作电极材料,硝酸银溶液作电解质溶液,则该装置图为: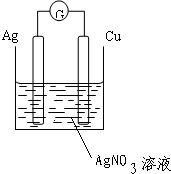 ,故答案为:
,故答案为: ;
;
(2)电子流向为负极从外电路流向正极即铜从外电路流向银,故答案为:电子铜从外电路流向银;
(3)根据Cu+2AgNO3═Cu(NO3)2+2Ag反应方程式知,Cu失电子发生氧化反应为负极,反应式为:Cu-2e-=Cu2+;正极为AgNO3得电子发生还原反应,反应式为:2Ag++2e-=2Ag,故答案为:(+)2Ag++2e-=2Ag,(-)Cu-2e-=Cu2+.
点评 原电池的构成条件:
1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;
2、电极均需插入电解质溶液中;
3、两极相互连接(或接触);
4、能自发地发生氧化还原反应.

练习册系列答案
相关题目
14.下列物质中,属于电解质的是( )
| A. | 铜 | B. | 食盐水 | C. | 石墨 | D. | 食盐晶体 |
15.用NA表示阿伏加德罗常数的值,下列有关说法错误的是( )
| A. | 1.6g氧气含有氧原子的数目为0.1NA | |
| B. | 0.5mol NH3含有的原子数目为1.5NA | |
| C. | 1mol CO2中含有的CO2分子数为NA | |
| D. | 0.5NA个臭氧(O3)分子的物质的量是0.5mol |
12.由二氧化碳与氧气按体积比1:2混合而成的气体其摩尔质量为( )
| A. | 38 | B. | 38g/mol | C. | 36 | D. | 36g/mol |
9.将一定体积质量分数为14%的KOH溶液100g加热蒸发至体积为50mL,冷却至室温无晶体析出,此时溶液的物质的量浓度为( )
| A. | 5mol•L-1 | B. | 6.25mol•L-1 | C. | 7mol•L-1 | D. | 6.75mol•L-1 |
16.下列关于Fe(OH)3胶体的说法正确的是( )
| A. | 向Fe(OH)3胶体中加入过量的稀硫酸,产生胶体聚沉 | |
| B. | 除去Fe(OH)3胶体中混有的FeCl3溶液可选择渗析的方法 | |
| C. | 向沸腾的蒸馏水中逐滴滴加饱和FeCl3溶液,并不断搅拌即得到Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体带正电荷,在通电时胶体微粒向直流电源的负极移动,这种现象称为电流 |
13.石蕊(用HIn表示)是一种常用的酸性指示剂,其电离方程式为HIn?H++In-,已知它在pH<5的溶液中呈红色,在pH>8的溶液中呈蓝色,下列判断中不正确的是( )
| A. | HIn呈红色 | B. | In-呈蓝色 | ||
| C. | 加入碱溶液后n(In-)增大 | D. | HIn呈蓝色 |
20.下列离子方程式,正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 铁与H2SO4反应:Fe+2H+═Fe3++H2↑ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |