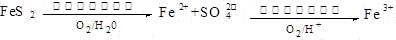��Ŀ����
�������������Ʒ�ӹ����ϣ�������GeO2����Ҫ;��������������ͼ��
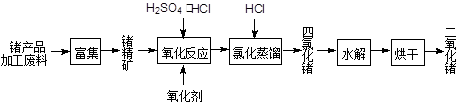
��1��Ge2+��������H2O2��Ӧ����Ge4+��д���÷�Ӧ�����ӷ���ʽ ��
��2������ɻ�÷е�ϵ͵�GeCl4���ڴ˹����м���Ũ�����ԭ���� ��ʵ�����������ʱ���õIJ��������У��ƾ��ơ�������ƿ�� �� �����չܡ���ƿ�ȡ�
��3��GeCl4ˮ������GeO2��nH2O���˹����û�ѧ����ʽ�ɱ�ʾΪ ��
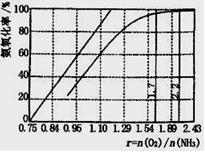
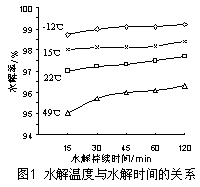
�¶ȶ�GeCl4��ˮ���ʲ�����Ӱ����ͼ1��ʾ����ԭ���� �� Ϊ������ѵķ�Ӧ�¶ȣ�ʵ��ʱ�ɲ�ȡ�Ĵ�ʩΪ ������ţ���
A���ñ�ˮ����� B��49��ˮԡ C���ñ���ˮ
��4�����Ge��Ԫ�����ڱ��е�λ�ü����Խ��ߡ�������GeO2�ܽ�����pH �仯��ԭ�� �������ӷ���ʽ��ʾpH��8ʱGeO2�ܽ���������ܷ����ķ�Ӧ ��
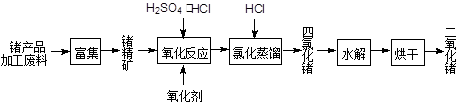
��1��Ge2+��������H2O2��Ӧ����Ge4+��д���÷�Ӧ�����ӷ���ʽ ��
��2������ɻ�÷е�ϵ͵�GeCl4���ڴ˹����м���Ũ�����ԭ���� ��ʵ�����������ʱ���õIJ��������У��ƾ��ơ�������ƿ�� �� �����չܡ���ƿ�ȡ�
��3��GeCl4ˮ������GeO2��nH2O���˹����û�ѧ����ʽ�ɱ�ʾΪ ��
�¶ȶ�GeCl4��ˮ���ʲ�����Ӱ����ͼ1��ʾ����ԭ���� �� Ϊ������ѵķ�Ӧ�¶ȣ�ʵ��ʱ�ɲ�ȡ�Ĵ�ʩΪ ������ţ���

A���ñ�ˮ����� B��49��ˮԡ C���ñ���ˮ
��4�����Ge��Ԫ�����ڱ��е�λ�ü����Խ��ߡ�������GeO2�ܽ�����pH �仯��ԭ�� �������ӷ���ʽ��ʾpH��8ʱGeO2�ܽ���������ܷ����ķ�Ӧ ��
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| �ܽ���/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
��15�֣���1��Ge2++H2O2+2H+=Ge4++2H2O��2�֣�
��2������GeCl4ˮ�� �¶ȼ� �����ܣ���1�֣�
��3��GeCl4+ (2+n) H2O = GeO2��nH2O��+ 4HC1 ��ˮ�ⷴӦ��һ�����ȷ�Ӧ C����2�֣�
��4����������������� GeO2+2OH��= GeO32��+H2O ����2�֣�
��2������GeCl4ˮ�� �¶ȼ� �����ܣ���1�֣�
��3��GeCl4+ (2+n) H2O = GeO2��nH2O��+ 4HC1 ��ˮ�ⷴӦ��һ�����ȷ�Ӧ C����2�֣�
��4����������������� GeO2+2OH��= GeO32��+H2O ����2�֣�
�����������1����Ԫ����+2��Ϊ+4�ۣ��� Ge2+�ǻ�ԭ����H2O2������������Ԫ���ɡ�1��Ϊ��2�ۣ���ԭ����ΪH2O�����ݵ��ӡ���ɺ�ԭ���غ���ƽ����Ge2++H2O2+2H+=Ge4++2H2O����2��GeCl4��ǿ�������Σ���ˮ��Һ����ˮ�⣬����Ũ������ʹ��ˮ��ƽ�����ƣ�������ˮ�⣬��ֹ����ʣ�������Ҫ�õ��������Ǿƾ��ơ�������ƿ������̨���¶ȼơ������ܡ�����������ƿ����3��GeO2��nH2O��ˮ��������ϵ��Ϊ1��������ԭ�ӡ���ԭ�ӡ���ԭ�ӡ���ԭ���غ㣬���ˮ�ⷴӦΪGeCl4+ (2+n) H2O = GeO2��nH2O+ 4HC1����ͼ�������¶ȣ�GeCl4��ˮ���ʼ�С��ǰ����ʹƽ�������ȷ�Ӧ�����ƶ�������˵��ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ����������Ӧ�����Ƿ��ȷ�Ӧ����ͼ��֪����12��ʱGeCl4��ˮ������ߣ����ò�Ʒ�IJ������ˮ�������¶�ԼΪ0�棬��A����49��ʱGeCl4��ˮ������С�����ò�Ʒ�IJ�����С����B������ˮ���¶ȿ���Ϊ��12�棬��C��ȷ����4���������λ��Ԫ�����ڱ��н�����ǽ��������߸��������������Ͻ�����Ԫ�أ�����������������ƣ��ɴ��ƶ�GeO2��Al2O3���ƣ������������������Al2O3+6H+=2Al3++3H2O��Al2O3+2OH��=2AlO2��+H2O���ɴ˿ɷ�д��GeO2+4H+=Ge4++2H2O��GeO2+2OH��=GeO32��+H2O��ǰ����pH<8ʱGeO2�ܽ����������Ҫԭ������pH>8ʱGeO2�ܽ����������Ҫԭ��

��ϰ��ϵ�д�
 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д�
�����Ŀ
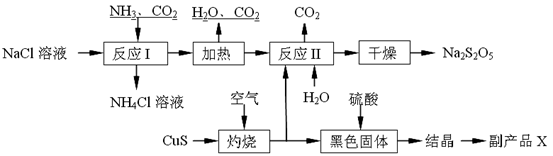
 Na2S2O5��H2O�ȶಽ��Ӧ��
Na2S2O5��H2O�ȶಽ��Ӧ��