题目内容
(8分)下表是五种主族元素的结构特点及其元素、单质、化合物的性质。
元素 | 结构特点及元素、单质、化合物的性质 |
X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
W | 最外层电子排布(n+1)s n (n+1)p n-1 |
T | 单质升华可以产生紫色的烟 |
(1)写出X元素的原子核外电子排布 ;其单质的化学性质 (填“稳定”或“活泼”),该元素的非金属性 (填“强”或“弱”),证明其强弱的理由是 。
![]() (2)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反应的离子方程式: , 。
(2)W的最高价氧化物对应水化物可以与X、Z的最高价氧化物对应水化物反应,写出反应的离子方程式: , 。
![]() (3)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式 。
(3)Z单质在空气中燃烧生成黄色粉末,写出该物质的电子式 。
![]() (4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱。Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为
(4)一种元素有多种可变价态,一般高价氧化物对应水化物成酸,低价氧化物对应水化物成碱。Y、T可形成多种化合物,其中T元素的化合价为+3、+5时,形成的化合物的化学式为
![]() A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3
A.T2Y4 B.T4Y9 C.T6Y10 D.T2Y3
(1)电子排布 1s22s22p3 ;化学性质 稳定 ,非金属性 强 ,理由是 硝酸是强酸 。
(2)离子方程式: Al(OH)3+3H+→Al3++3H2O ,
Al(OH)3+OH-+→AlO2-+2H2O 。
(3)电子式 Na+[:O:O:]2-Na+ (4)化学式为( B )

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
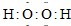
 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:

 NH3?H2O+H+
NH3?H2O+H+ (2012?闸北区二模)某同学在研究前l8号元素时发现,可以将它们按原子序数递增的顺序排成如右图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.
(2012?闸北区二模)某同学在研究前l8号元素时发现,可以将它们按原子序数递增的顺序排成如右图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.