题目内容
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)写出H2C2O4溶液和酸性KMnO4溶液反应的离子方程式___________;
(2)探究温度对化学反应速率影响的实验编号是_____(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____;
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率υ(KMnO4)=_____mol/(L·min);
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图________。
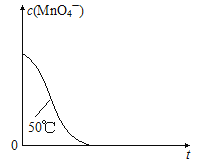
【答案】2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O ②③ ①② 0.010或1.0×102 
【解析】
(1)根据题中信息及化合价升降法配平反应的化学方程式,将该化学方程式改成离子方程式即可;
(2)根据探究温度对反应速率影响时除了温度外其它条件必须相同判断;根据探究浓度对反应速率影响时除了浓度不同,其他条件必须完全相同分析;
(3)先根据醋酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(4)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线示意图。
(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,改写成离子方程式为:2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①②,故答案为:②③;①②;
(3)草酸的物质的量为:0.10molL1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010molL1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:![]() =
=![]() ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)= ![]() ×0.010mol/L÷
×0.010mol/L÷![]() =0.010 mol/(L·min)或1.0×102 mol/(L·min),故答案为:0.010或1.0×102;
=0.010 mol/(L·min)或1.0×102 mol/(L·min),故答案为:0.010或1.0×102;
(4)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为: 。
。

【题目】下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
选项 | 离子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Na+、NO | 逐滴滴加盐酸立即有气体产生 |
C | Na+、Al3+、Mg2+、SO | 逐滴滴加氨水立即有沉淀产生 |
D | NH | 滴加NaOH浓溶液立刻有气体产生 |
A.AB.BC.CD.D