题目内容
13.有几种常见仪器:①容量瓶、②分液漏斗、③酒精灯、④试管、⑤天平.请根据它们的用途或特征回答问题(用序号填写):(1)只有一个刻度线的仪器是①.
(2)分离汽油和水的混合物必须用到的仪器是②.
(3)在实验室中通常作为热源的仪器是③.
分析 (1)容量瓶只有一个刻度;
(2)汽油和水互不相溶;
(3)酒精灯是实验室最常用的加热装置.
解答 解:(1)分液漏斗、酒精灯、试管都没有刻度,天平有多个刻度,而容量瓶只有一个刻度,故答案为:①;
(2)汽油和水互不相溶,汽油和水的混合物静置后分层,可以采取分液操作,分液操作用到的主要仪器是分液漏斗,故答案为:②;
(3)酒精灯是实验室最常用的加热装置,因此在实验室中通常作为热源的仪器是酒精灯,故答案为:③.
点评 本题考查基本实验仪器的用途和使用方法,为高频考点,侧重考查学生的分析、实验能,题目涉及分液操作原理,十分基础,平时注意知识的积累.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
16.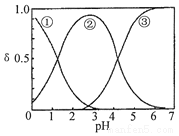 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)增大 |
4.下列说法错误的是( )
| A. | 焰色反应与电子跃迁有关 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | 元素电负性越大的原子,吸引电子的能力越强 | |
| D. | 根据对角线规则,H3BO3是弱酸 |
1.下列溶液中,跟100mL 1mol/L NaCl溶液所含的Cl-数目相同的是( )
| A. | 25mL 0.5mol/L HCl溶液 | B. | 200mL 0.5mol/L KCl溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 100mL 0.5mol/L MgCl2溶液 |
18.下列物质的转化在给定条件下能实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{盐酸}{→}$H2SiO3 | |
| D. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{点解}{→}$Mg |
5.下列说法正确的是( )
| A. | 22.4LN2含阿伏加德罗常数个氮分子 | |
| B. | 在标准状况下,11.2 L四氯化碳所含分子数为0.5NA | |
| C. | 22g二氧化碳与标准状况下11.2LH2含有相同的原子数 | |
| D. | 常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA |
2.下列说法正确的是( )
| A. | 32gO2占有的体积为 22.4L | |
| B. | 22.4LN2 含有阿伏加德罗常数个 N2 | |
| C. | 在标准状况下,22.4L 水的物质的量为 1mol | |
| D. | 22gCO2 和 16gO2,在同温、同压下占有的体积相同 |
7.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
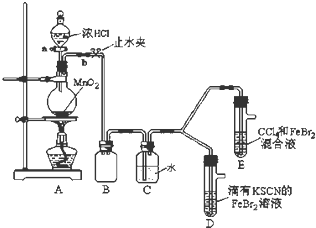
(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.