题目内容
16.元素周期表是学习物质结构与性质的重要工具.下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素.请用所给元素回答下列问题.
(1)Q元素在元素周期表中的位置第三周期ⅥA族,Q元素原子结构示意图为

(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)S2->Cl->K+.
(3)M、D两元素形成的化合物中含有的化学键类型是共价键,其MD2分子的结构式:O=C=O
(4)用电子式表示物质GDA
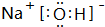 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程 ;
;(5)用表中所给元素组成反应物,请用一个化学方程式说明元素Q和R非金属性的强弱:Na2S+C12=2NaC1+S↓;
(6)请写出H的最高价氧化物与NaOH溶液反应的离子反应方程式:Al2O3+2OH-═2AlO2-+H2O.
分析 根据元素在周期表中的位置,可知A是H,M是C,B是N,D是O,G是Na,H是Al,Q是S,R是Cl,E是K.
(1)由Q位置可知其位于第三周期ⅥA族;原子核外有16个电子,有3个电子层,各层电子数为2、8、6;
(2)电子层结构相同,核电荷数越大离子半径越小;
(3)C、O两元素形成的化合物有CO、CO2,原子之间均形成共价键,二氧化碳中碳和氧原子间形成2对共用电子对;
(4)NaOH由钠离子与氢氧根离子构成;G与Q形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
(5)利用单质之间的相互置换反应进行验证,如氯气与硫化钠反应生成硫与NaCl,可以证明Cl的非金属性强于硫;
(6)氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水.
解答 解:根据元素在周期表中的位置,可知A是H,M是C,B是N,D是O,G是Na,H是Al,Q是S,R是Cl,E是K.
(1)由Q位置可知其位于第三周期ⅥA族;原子核外有16个电子,有3个电子层,各层电子数为2、8、6,原子结构示意图为 ,
,
故答案为:第三周期ⅥA族; ;
;
(2)电子层结构相同,核电荷数越大离子半径越小,故离子半径:S2->Cl->K+,故答案为:S2->Cl->K+;
(3)C、O两元素形成的化合物有CO、CO2,原子之间均形成共价键,二氧化碳中碳和氧原子间形成2对共用电子对,结构式为:O=C=O,故答案为:共价键;O=C=O;
(4)NaOH由钠离子与氢氧根离子构成,电子式为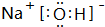 ;G与Q形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成为:
;G与Q形成化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成为: ,故答案为:
,故答案为: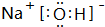 ;
; ;
;
(5)氯气与硫化钠反应生成硫与NaCl,可以证明Cl的非金属性强于硫,反应方程式为:Na2S+C12=2NaC1+S↓;故答案为:Na2S+C12=2NaC1+S↓;
(6)Y的氧化物为Al2O3,与NaOH溶液反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O.
点评 本题考查元素周期表与元素周期律,难度不大,关键是要在有一个完整准确的元素周期表判断元素,(5)中用化学方程式说明非金属性强弱为易错点.

| A. | 标准状况下22.4 L NO与11.2 L O2混合后所得气体分子数为6.02×1023 | |
| B. | 标准状况下3.36 L CCl4含碳原子数为0.15×6.02×1023 | |
| C. | 1 mol甲基(-CH3)中所含电子数为9×6.02×1023 | |
| D. | 2 L 1 mol•L-1 的盐酸中所含氯化氢分子数为2×6.02×1023 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
(2)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(3)B、E形成的化合物为Al2O3(填化学式).
| A. | 氯原子的结构示意图: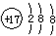 | |
| B. | N2的电子式: | |
| C. | CH4分子的比例模型: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
| A. | Fe2+、Na+、Cl-、SCN- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Al3+、Na+、Cl-、NH3•H2O |
| A. | CO2与炭化合 | B. | 碳酸钙分解反应 | C. | 铝热反应 | D. | 制水煤气反应 |
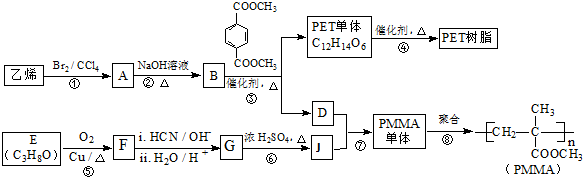 已知:
已知: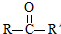 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$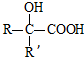 (R、R’代表烃基)
(R、R’代表烃基) .
. .
. .
.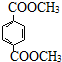 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH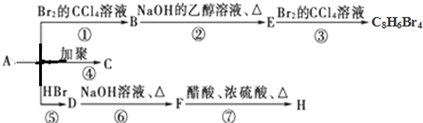
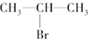 (主要产物)
(主要产物)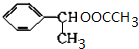 ,
,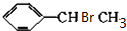 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$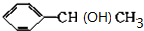 +NaBr.
+NaBr.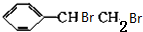 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$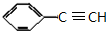 +2NaBr+2H2O
+2NaBr+2H2O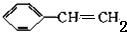 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$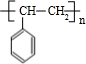 .
. 如图是某兴趣小组探究不同条件下化学能转变为电能的装置
如图是某兴趣小组探究不同条件下化学能转变为电能的装置