题目内容
为了提纯食盐水,需将食盐水中含有Ca2+,Mg2+, ,
, 等离子一一除去,所加入试剂的正确顺序为
等离子一一除去,所加入试剂的正确顺序为
[ ]
A.Na2CO3→BaCl2→NaOH→HCl
B.NaOH→Na2CO3→BaCl2→HCl
C.BaCl2→NaOH→Na2CO3→HCl
D.BaCl2→Na2CO3→NaOH→HCl
解析:
|
首先明确各种杂质离子分别用哪种试剂除去:Ca2+—Na2CO3;Mg2+—NaOH; |
提示:
|
解答这类题时,首先要找出除去各离子的试剂,其次是摆出所加试剂的顺序.在摆顺序时,要求所加试剂不仅能除去相应的离子,而且还能将前面所加过量试剂的离子也除去,这样才能得出正确答案. |

 优学名师名题系列答案
优学名师名题系列答案电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源 极,电极反应为 ;通电一段时间后,溶液中铜离子浓度将 (增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为 ;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
|
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阴极溶液中加适量盐酸,可以
恢复到电解前的物质的浓度
 —BaCl2;
—BaCl2; —HCl.再明确加试剂顺序问题:因为前三种试剂应加过量,以确保杂质离子被除干净,但又不允许引入新杂质,所以BaCl2要在Na2CO3前面加入,因为过量的Ba2+可与
—HCl.再明确加试剂顺序问题:因为前三种试剂应加过量,以确保杂质离子被除干净,但又不允许引入新杂质,所以BaCl2要在Na2CO3前面加入,因为过量的Ba2+可与 反应生成BaCO3沉淀而被除掉;NaOH和Na2CO3要在HCl前面加入,因为过量的OH-和
反应生成BaCO3沉淀而被除掉;NaOH和Na2CO3要在HCl前面加入,因为过量的OH-和 可与H+反应生成H2O和CO2而被除掉.最后的HCl滴加至pH=7为止,即可得食盐水.
可与H+反应生成H2O和CO2而被除掉.最后的HCl滴加至pH=7为止,即可得食盐水.

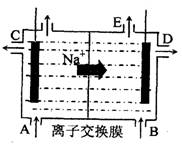 原理示意图。电极反应为:
原理示意图。电极反应为: