题目内容
含Cr2O72-的酸性工亚废水会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转变为Cr(OH)3除去。工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓人空气。结果溶液的pH不断升高,溶液由酸性转为碱性。在以上处理过程中,溶液pH升高的原因是( )A. 电解时废水体积减小
B. 鼓人空气使溶液中OH-浓度增大
C. 电解时H+在阴极被还原
D. Cr2O72-被还原为Cr3+时消耗了H+
答案:CD
解析:
解析:
| 点拨解答:分析此电解反应的原理如下:
阳极铁被氧化,电极反应式为:Fe-2e-=Fe2+ 阴极溶液中的H+被还原,电极反应式为2H+-2e-=H2↑ 除去Cr2O72-的总反应式为:Cr2O72—+6Fe2++8H+=2Cr(OH)3+6Fe3++H2O 综上所述,在电解过程中,阴极消耗了溶液中的H+产生氢气,降低了溶液的酸性,同时,在Cr2O72-与Fe2+反应被还原为Cr3+的过程中,又消耗了溶液中的H+使溶液的酸性减弱,从而生成Cr(OH)3沉淀,降低了废水中有害物质铬的污染。所以,导致溶液酸性减弱的因有上述两个。因此,本题答案应选CD。
|

练习册系列答案
相关题目

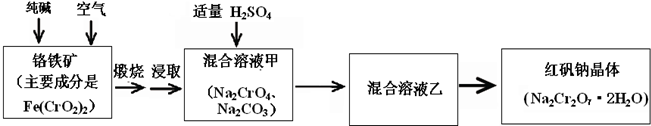

 (2010?汕头一模)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下
(2010?汕头一模)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下 Cr2O72-+H2O
Cr2O72-+H2O