题目内容
已知实验室制氯气的化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O,其中:
(1)MnO2中Mn元素被
(2)HCl中氯原子
(3)反应中还原剂与氧化剂的物质的量之比为
(4)若参加反应的HCl是146g,则被氧化的HCl是
(5)用单线桥法表示此反应中电子转移情况.MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O.
(1)MnO2中Mn元素被
还原
还原
.(2)HCl中氯原子
失去
失去
(填“得到”或“失去”)电子.(3)反应中还原剂与氧化剂的物质的量之比为
2:1
2:1
.(4)若参加反应的HCl是146g,则被氧化的HCl是
2
2
mol.(5)用单线桥法表示此反应中电子转移情况.MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O.
分析:(1)氧化还原反应中,得电子化合价降低的元素被还原;
(2)在氧化还原反应中,失电子化合价升高的元素被氧化;
(3)根据得失电子确定还原剂和氧化剂的物质的量关系;
(4)根据参加反应的氯化氢和被氧化的氯化氢之间的关系式计算;
(5)根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目;
(2)在氧化还原反应中,失电子化合价升高的元素被氧化;
(3)根据得失电子确定还原剂和氧化剂的物质的量关系;
(4)根据参加反应的氯化氢和被氧化的氯化氢之间的关系式计算;
(5)根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目;
解答:解:(1)因反应中二氧化锰中的Mn元素的得电子化合价降低而被还原,故答案为:还原;
(2)反应中氯元素的化合价升高,则氯元素失去电子,故答案为:失去;
(3)由MnO2+4HCl=MnCl2+2H2O+Cl2↑可知,1molMnO2反应时氧化剂为1mol,但参加反应的4molHCl中只有
2molHCl作还原剂,即还原剂与氧化剂的物质的量之比为2:1,故答案为:2:1;
(4)参加氧化还原反应的氯化氢是参加反应的氯化氢的一半,所以被氧化的氯化氢的质量是73g,其物质的量=
=2mol,故答案为:2;
(5)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目 (浓)═MnCl2+Cl2↑+2H2O,故答案为:
(浓)═MnCl2+Cl2↑+2H2O,故答案为: (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.
(2)反应中氯元素的化合价升高,则氯元素失去电子,故答案为:失去;
(3)由MnO2+4HCl=MnCl2+2H2O+Cl2↑可知,1molMnO2反应时氧化剂为1mol,但参加反应的4molHCl中只有
2molHCl作还原剂,即还原剂与氧化剂的物质的量之比为2:1,故答案为:2:1;
(4)参加氧化还原反应的氯化氢是参加反应的氯化氢的一半,所以被氧化的氯化氢的质量是73g,其物质的量=
| 73g |
| 36.5g/mol |
(5)该反应中Cl元素失去电子,Mn元素得到电子,转移的电子总数为2e-,则电子转移的方向和数目
 (浓)═MnCl2+Cl2↑+2H2O,故答案为:
(浓)═MnCl2+Cl2↑+2H2O,故答案为: (浓)═MnCl2+Cl2↑+2H2O.
(浓)═MnCl2+Cl2↑+2H2O.点评:本题考查氧化还原反应,明确元素的化合价变化是解答本题得关键,注意该反应中只有一半的氯化氢参加氧化还原反应,为易错点.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
 (4)可用下图实验装置精制粗溴。
(4)可用下图实验装置精制粗溴。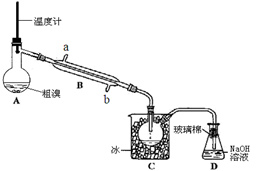
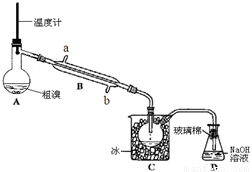
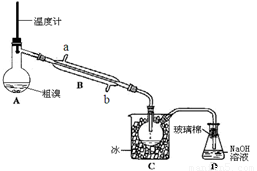
 ①反应过程中需要对A容器加热,加热的方法是
。
①反应过程中需要对A容器加热,加热的方法是
。